
在容积一定的密闭容器中,反应A2(g)+B2(g) xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )

A.P3<P4,y为A2转化率
B.P3<P4,y为A2浓度
C.P3>P4,y为混合气密度
D.P3>P4,y为C的体积分数
科目:高中化学 来源:2016-2017学年江西省高一12月月考化学卷(解析版) 题型:推断题
A、B、C、D、 E五种化合物中均含有地壳中含量最多的金属元素,它们的转化关系如图所示,其中A为澄清溶液,B、C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
E五种化合物中均含有地壳中含量最多的金属元素,它们的转化关系如图所示,其中A为澄清溶液,B、C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。

(1)写出化学式:A________,B________,C________,D________,E________。
(2)写出下列反应的离子方程式:
A→B:_____________________
A→D:_____________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一12月月考化学试卷(解析版) 题型:填空题
回答下列问题:
①工业上制造光导纤维的基本原料是 (填化学式)。
②下列物质中,不能用来制造耐火材料的是 。(填字母)
A.氧化镁 B.过氧化钠 C.三氧化二铝
③在生铁和钢这2种金属材料中,含碳量较高的是 。
④铁红的主要成分的化学式是___________。
⑤明矾在生活中可用作____________剂。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一12月月考化学试卷(解析版) 题型:选择题
下列关于Na2O2的说法中,不正确的是
A. 是浅黄色固体 B. 可用作供氧剂
C. 与H2O反应时,H2O作还原剂 D. 与H2O反应时,放出热量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南浏阳一中等两校高二12月联考化学卷(解析版) 题型:填空题
部分弱酸的电离平衡常数如表。
弱酸 | HCOOH | H2S | H2SO3 |
电离平衡常数 (25℃) | K=1.8×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×1 K2=6.6×10-8 |
(1)物质的量均为0.1mol/L的溶液①HCO ONa②NaHS③Na2SO3,pH最大的是________(填编号)
ONa②NaHS③Na2SO3,pH最大的是________(填编号)
(2)设计实验证明HCOOH为弱酸
(3)室温下,下列溶液中水电离出的c(H+)水由大到小的顺序为________(填编号)
①pH=12的NaOH溶液 ②NaCl溶液 ③pH=6的NH4Cl溶液 ④0.01mol/L醋酸
(4)二元酸H2A在水中存在以下电离:H2A=H++HA-,HA- H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
①NaHA溶液呈 (填“酸性”、“碱性”、“中性” )
②某温度下,10mL、0.1mol/LNaHA溶液中加入0.1mol/LKOH溶液VmL至中性,此时溶液中以下关系一定正确的是(  )
)
A.溶液的pH=7 B.Kw=c2(OH-) C.V=10 D.c(K+)< c(Na+)
(5)如图横坐标为室温下溶液的pH,纵坐标为金属离子物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答:
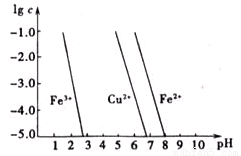
腐蚀铜板的溶液中,若Cu2+、Fe3+、Fe2+浓度均为0.1mol/L,向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。
从图中的数据计算可得Fe(OH)2溶度积Ksp[Fe(OH)2]= 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南浏阳一中等两校高二12月联考化学卷(解析版) 题型:选择题
常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+)
 D.0.4mol•L﹣1CH3COOH溶液与0.2mol•L﹣1NaOH溶液等体积混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH)
D.0.4mol•L﹣1CH3COOH溶液与0.2mol•L﹣1NaOH溶液等体积混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南浏阳一中等两校高二12月联考化学卷(解析版) 题型:选择题
升高温度能加快化学反应速率的主要原因是( )
A.增加活化分子百分数 B.降低活化分子的能量
C.活化分子能量明显增加 D.降低反应所需的能量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期末化学卷(解析版) 题型:选择题
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4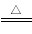 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.ClO2是氧化产物
B.KClO3在反应中得到电子
C.H2C2O4在反应中被还原
D.1 mol KClO3参加反应有2 mo l电子转移
l电子转移
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上联考四化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质]X、Y、Z、W是前四周期中常见的四种元素。X的基态原子核外电子共占据5个原子轨道,其中能量最高的能级上的电子有3种运动状态;Y能形成最强的无机含氧酸,Z的单质是前36号元素中最活泼的金属单质,W的一种核素的质量数是56,中子数是30。
(1)W的稳定价态离子的核外电子排布式为_________,Y、Z、W电负性由大到小的顺序为___________(填元素符号)。
(2)X与同周期相邻的另外两种元素相比其第一电离能最大,原因是_____________________X和与X同族的另外两种前四周期元素的简单氢化物的沸点由低到高的顺序为_______________,试解释其原因__________________
(3)XY3的中心原子轨道杂化类型为_________
(4)已知WY3的沸点为319 ℃,熔点为306 ℃,则WY3的晶体类型为____________Z的重要化合物Z2O2中存在的化学键类型有_______________
A.离子键 B.极性共价键 C.非极性共价键 D.π 键
(5)若Z的晶胞为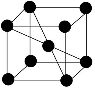 ,Z离子的半径为d cm,则Z单质的密度为_______。
,Z离子的半径为d cm,则Z单质的密度为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com