
(15分)已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
实验 1 | 实验步骤 | 实验现象 |
ⅰ.取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 | ⅰ.溶液呈棕黄色。 | |
ⅱ.向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ.溶液不显红色。 |
①写出FeCl3溶液与KI溶液反应的离子方程式 。
②加入KSCN溶液的目的是 。
③甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2。
实验 2 | 实验步骤 | 实验现象 |
ⅰ.取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ.溶液呈棕黄色。 | |
ⅱ.向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ.溶液显红色。 | |
ⅲ.继续加入2 mL CCl4,充分振荡、静置。 | ⅲ.液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是 。用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因: 。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I- I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
①为验证假设,乙同学设计并完成了实验3。
实验3 | 实验步骤 | 实验现象 |
ⅰ.取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 | ⅰ.液体分层,上层呈黄色,下层呈紫红色。 | |
ⅱ.取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 | ⅱ.液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是 。
②甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I- I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中 。
两支试管中的现象分别为 。
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高一3月月考化学试卷(解析版) 题型:选择题
同温同压下,某容器充满氧气重116g,若充满CO2重122g,现充满某气体X重114g。则该气体的相对分子质量为
A.28 B.60 C.32 D.44
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
X、Y、Z、W四种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构;W的阳离子的氧化性强于等电荷数的X阳离子的氧化性;Z的阴离子半径大于等电荷数的Y的阴离子半径,则四种元素的原子序数由大到小的顺序是
A.ZYXW B.WXYZ
C.XYZW D.ZXYW
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
下列各项中表达正确的是
A.H、D、T表示同一种核素
B.F-离子结构示意图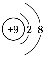
C.用电子式表示HCl形成过程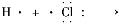
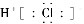
D.次氯酸电子式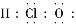
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三一模理综化学试卷(解析版) 题型:选择题
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色)
2H++ 2CrO42-(黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+ ===2Cr3+(绿色) + 6Fe3+ + 7H2O。
下列分析正确的是
A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B.实验②能说明氧化性:Cr2O72- > Fe3+
C.CrO42-和Fe2+在酸性溶液中可以大量共存
D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东湛江高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
(16分)某工业废玻璃粉末含SiO2、Fe2O3、CeO2、FeO等。某课题小组设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾。
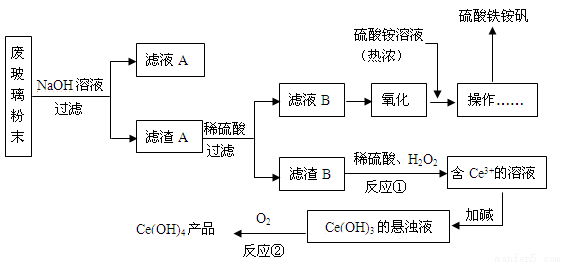
已知:CeO2不溶于稀硫酸;酸性条件下,Ce3+易水解,Ce4+有较强氧化性。
(1)硫酸铁铵矾可净水,其原理是(写离子方程式) 。
(2)滤液A的主要成分 (填写化学式)。
(3)反应①的离子方程式是 。
(4)反应②的化学反应方程式是 。
(5)已知制硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的产率为80%,若加入13.2g(NH4) 2SO4(式量132),可制得晶体的质量是 。
(6)化合物HT可作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为:
Ce2(SO4)3 (水层)+ 6HT(有机层) 2CeT3 (有机层)+3H2SO4(水层)
2CeT3 (有机层)+3H2SO4(水层)
分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是:
(从平衡移动角度回答)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
某混合溶液中,含溶质X、Y各0.1 mol,向其中滴加0.1 mol/L的Z溶液,所得沉淀的物质的量如下图,则符合条件的X、Y、Z分别是
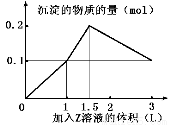
A.氯化铝、 氯化铁、 氢氧化钠
B.氯化铝、 氯化镁、 氢氧化钠
C.偏铝酸钠、 氯化钡、 硫酸
D.偏铝酸钠、 氢氧化钡、 硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第二次模拟理综化学试卷(解析版) 题型:简答题
(14分)含氮化合物是重要的化工原料。存在如下转化关系:
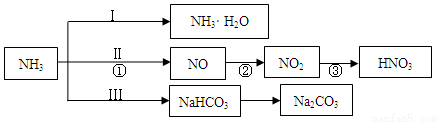
(1)工业上常用浓氨水检验氯气管道是否泄漏。
①氨气溶于水的过程中存在的平衡有 (用离子方程式表示)。
②向固体氧化钙中滴加浓氨水,可用于实验室制取少量氨气,简述原理 。
(2)转化Ⅱ中发生的系列反应,在工业上可以用来制备硝酸,写出①中反应的化学方程式为 。
(3)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。转化Ⅲ中部分反应如下:
NH3+CO2+H2O  NH4HCO3,NH4HCO3+NaCl(饱和)
NH4HCO3,NH4HCO3+NaCl(饱和) NaHCO3↓+NH4Cl。
NaHCO3↓+NH4Cl。
①转化Ⅲ中有NaHCO3沉淀析出的原因是 。
②欲测定某工业纯碱样品中Na2CO3的质量分数,某同学设计方案如下:
准确称取10.00g样品,加入过量的盐酸,充分反应,蒸干、冷却后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。样品中碳酸钠的质量分数为 。
(4)以氨作为燃料的固体氧化物(含有O2一)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:
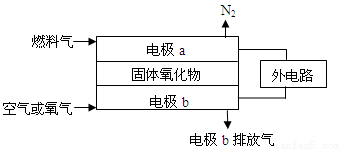
①固体氧化物作为电池工作的电解质,O2一移向 (填字母)。
A.电极a B.电极b
②该电池工作时,电极a上发生的电极反应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com