
| A、向AgNO3溶液中滴加氨水至过量:Ag++NH3?H2O═AgOH↓+NH4+ |
| B、向Mg(OH)2悬浊液中滴加FeCl3溶液:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
| C、向Na2S2O3溶液中加入足量稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
D、向苯酚钠溶液中通入少量CO2气体: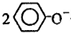 +CO2+H2O→2 +CO2+H2O→2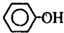 +CO32- +CO32- |


科目:高中化学 来源: 题型:
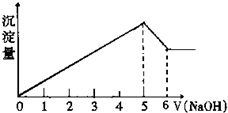 有一镁、铝合金,在适量稀硫酸中恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠溶液的体积变化如图所示,则合金中镁、铝的物质的量之比为( )
有一镁、铝合金,在适量稀硫酸中恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠溶液的体积变化如图所示,则合金中镁、铝的物质的量之比为( )| A、2:1 | B、4:1 |
| C、1:1 | D、1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
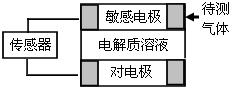 气体的自动化检测中常常应用原电池原理.如图为该电池工作的示意图:气体扩散进入敏感电极,发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.(对电极:即与敏感电极对应相反的电极)则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理.如图为该电池工作的示意图:气体扩散进入敏感电极,发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.(对电极:即与敏感电极对应相反的电极)则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A、检测Cl2时,电解质溶液中的阴离子向敏感电极移动 |
| B、上表气体检测时,敏感电极均作电池正极 |
| C、检测含相同物质的量的H2S和CO两份空气样本时,传感器上流过的电子物质的量之比为4:1 |
| D、检测H2S气体时,在对电极上充入空气,对电极上的电极反应式为:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水中通入过量SO2:SO2+NH3?H2O═NH4++HSO3- | ||||
| B、(CH3COO)2Ba溶液中加入稀硫酸:Ba2++SO42-═BaSO4↓ | ||||
C、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| D、Al2(SO4)3溶液中加入足量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、页岩气是从页岩层中开采出来的天然气.产气页岩分布广、厚度大,且普遍含气,故可以成为提供廉价而充足的新型燃料来源 |
| B、2013年1月1日起,我省正式发布环境空气质量指数(AQI),包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标 |
| C、目前我市的汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物 |
| D、竹炭具有超强的吸附能力,能吸附新装修房屋内的所有有害气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2═2I2+2H2O | ||||
| B、向K2Cr2O7溶液中滴加少量浓硫酸,溶液变为黄色:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ | ||||
| C、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合有白色沉淀生成:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | ||||
D、用铜电极电解饱和食盐水:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
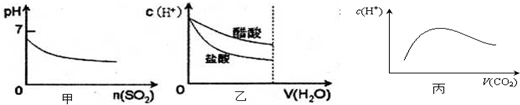
| A、甲是向溴水通入S02气体时,pH与S02物质的量的关系图 |
| B、乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
| C、常温常压下,将2b mol CO2气体通入1L b mol?L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系 |
| D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
| B、0.1mol?L-1 FeCl3溶液:NH4+、H+、I-、SCN- | ||
| C、0.1mol?L-1 Na2CO3溶液:K+、Ca2+、HCO3-、SO42- | ||
| D、使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
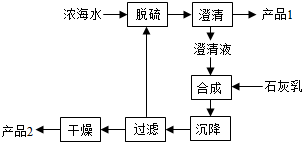
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com