
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ
2HI(g)+9.48kJ
(ii)I2(s)+H2(g)=2HI(g)-26.48kJ
下列判断正确的是
A.254gI2(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定
D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
【答案】D
【解析】
A、氢气与碘的反应为可逆反应,反应不能完全进行;
B、根据盖斯定律结合方程式求出,固态碘转化为气态碘的热效应;
C、同一物质稳定性相同;
D、产物相同,放出的热量越多,则反应物具有的能量越高。
A.因为是可逆反应,所以不能进行完全,放热小于9.48kJ,故A错误;
B.由盖斯定律知(Ⅰ)-(Ⅱ)得I2(g)=I2(S)+35.96kJ,故1 mol固态碘与1 mol气态碘所含的能量相差35.96kJ,故B错误;
C.反应(Ⅰ)、反应(Ⅱ)的产物都是HI(g),状态相同,稳定性一样,故C错误;
D.对于同一物质,固态物质的能量比气态物质能量低,故反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低,故D正确;
故选:D。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】H是一种香料的成分之一,其结构中含有三个六元环。G的结构简式为 ,H的合成路线如图(部分产物和反应条件略去):
,H的合成路线如图(部分产物和反应条件略去):

已知:①B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
②RCH=CH2+CH2=CHR’![]() CH2=CH2+RCH=CHR’
CH2=CH2+RCH=CHR’
③D和G是同系物
(1)用系统命名法命名(CH3)2C=CH2____________。
(2)A→B反应过程中涉及的反应类型有________。
(3)G分子中含氧官能团的名称:________。
(4)写出生成F的化学方程式_____________。
(5)写出C的结构简式:________。
(6)同时满足下列3个条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有________种(不包括立体异构),其中核磁共振氢谱为4组峰的为________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌—空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时,下列说法正确的是
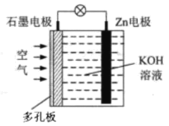
A.Zn电极是该电池的正极
B.Zn电极的电极反应:Zn+H2O-2e=ZnO+2H+
C.OH向石墨电极移动
D.标准状况下,当消耗11.2LO2时,电路中流过2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )
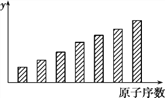
A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在空气中泄漏的二氧化硫,会被氧化而形成硫酸雾或硫酸盐气溶胶,污染环境。工业上常用Na2SO3溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
(1)写出用Na2SO3溶液吸收SO2的离子方程式。________________
(2)钠原子核外有________种能量不同的电子。写出硫原子最外层电子的轨道表示式。____________
(3)H2O比H2S稳定,请用分子结构的知识简述其理由。______________________
II.一定温度下,固定容积的密闭容器中反生下列反应:2C(s)+2SO2(g) ![]() S2(g)+2CO2(g),反应过程中,各物质浓度与时间的关系如图:
S2(g)+2CO2(g),反应过程中,各物质浓度与时间的关系如图:
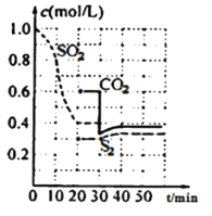
(4)该反应平衡常数表达式为K=________
(5)0~20min化学反应速率表示v(SO2)=________;建立平衡过程中,混合气体的密度________(选填“增大”、“减小”或“不变”)简述其原因。___________________________
(6)30min时改变外界条件,使v(正)________v(逆)(选填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业烧碱中常含氯化钠等杂质。
(1)简述检验工业烧碱中含有氯化钠的实验方法___;
(2)写出一种工业烧碱中还可能含有的杂质的化学式___;
(3)某同学采用硝酸银将离子沉淀的方法测定工业烧碱的纯度,取ag样品,经一系列操作,分离并称得氯化银的质量mg,则氢氧化钠纯度计算式为__。已知该测定结果偏低,可能的原因是__;
A.未将氢氧化钠去除 B.氯化银颗粒细小,难以过滤
C.氯化银部分分解 D.氯化银沉淀未洗涤干燥
(4)粗盐提纯过程中,除去硫酸根离子可选用的试剂是__;
A.氯化钡 B.氢氧化钡 C.硝酸钡 D.盐酸
(5)氯化钾的熔点低于氯化钠,从物质结构的角度加以解释___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“张亭栋研究小组”受民间中医启发,发现As2O3对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)为第VA族元素,该族元素的化合物在研究和生产中有着许多重要用途。
(1)N原子的价电子排布式为___,N、P、As原子的第一电离能由大到小的顺序为___。
(2)NH3的沸点比AsH3的沸点高,原因是_____。
(3)立方氮化硼晶体(BN),是一种超硬材料,有优异的耐磨性,其晶胞如图所示。
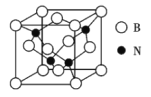
立方氮化硼是____晶体,晶体中N原子的杂化轨道类型为___,B原子的配位数为______。
(4)若立方氮化硼晶胞的边长为362 pm,则立方氮化硼的密度为____g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com