
【题目】A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):![]()
(1)若A为H2S,D的水溶液能使湿润的蓝色石蕊试纸变红,B为刺激性气味气体,写出B→C转化的化学反应方程式:________________________________________。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红:A的化学式为______,实验室制备气体A的化学反应方程式__________________________,A→B转化的化学方程式为_____________________________________________________。
(3)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则B是(填化学式)________, C可作为呼吸面具的填充剂,C与二氧化碳发生反应的化学方程式为________________________________,C与水发生反应的离子方程式为___________________________________________________。
【答案】 2SO2 + O2 ![]() 2SO3 NH3 2NH4Cl + Ca(OH)2
2SO3 NH3 2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑+ 2H2O 4NH3 + 5O2
CaCl2 + 2NH3↑+ 2H2O 4NH3 + 5O2 ![]() 4NO + 6H2O Na2O 2Na2O2 + 2CO2 = 2Na2CO3 + O2 2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑
4NO + 6H2O Na2O 2Na2O2 + 2CO2 = 2Na2CO3 + O2 2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑
【解析】(1)若A为H2S,D的水溶液能使湿润的蓝色石蕊试纸变红,B为刺激性气味气体,则B为二氧化硫,C为三氧化硫,D为硫酸, B→C转化的化学反应方程式为2SO2 + O2 ![]() 2SO3,故答案为:2SO2 + O2
2SO3,故答案为:2SO2 + O2 ![]() 2SO3;
2SO3;
(2)A的水溶液能使湿润的红色石蕊试纸变蓝,说明A是氨气,则B是一氧化氮,C是二氧化氮,D是硝酸。实验室制备气体氨气的化学反应方程式为2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑+ 2H2O,氨气催化氧化的方程式为4NH3 + 5O2
CaCl2 + 2NH3↑+ 2H2O,氨气催化氧化的方程式为4NH3 + 5O2 ![]() 4NO + 6H2O,
4NO + 6H2O,
故答案为:NH3;2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑+ 2H2O 4NH3 + 5O2
CaCl2 + 2NH3↑+ 2H2O 4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
(3)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,C可作为呼吸面具的填充剂,则A为钠,B为氧化钠,C为过氧化钠,D为氢氧化钠。 过氧化钠与二氧化碳发生反应的化学方程式为2Na2O2 + 2CO2 = 2Na2CO3 + O2,过氧化钠与水发生反应的离子方程式为2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑,故答案为:Na2O;2Na2O2 + 2CO2 = 2Na2CO3 + O2;2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑。


科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A.氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
B.在加入铝粉能放出氢气的溶液中,K+、NH![]() 、CO
、CO![]() 、Cl-一定能够大量共存
、Cl-一定能够大量共存
C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D.依据铝热反应原理,能发生反应2Al+3MgO ![]() 3Mg+Al2O3
3Mg+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.A点溶液中加入少量水:![]() 增大
增大
B.B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C.C点:c(Na+) =c(HA-)+2c( A2-)
D.水电离出来的c(OH -):B点>D点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
已知:①经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
②SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③SrCl2·6H2O的摩尔质量为267 g/mol。
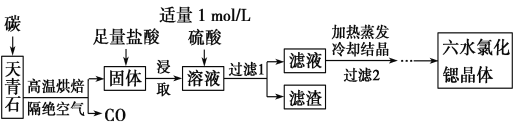
(1) 工业上天青石焙烧前先研磨粉碎,其目的是______________。
(2) 工业上天青石隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_________________________。
(3)加入硫酸的目的是____________________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于___________mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.200 0 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_______________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
(5)工业上常用电解熔融SrCl2制锶单质。由SrCl2·6H2O制取无水氯化锶的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下反应的化学方祝式或离子方程式:
(1)铝与黑色铁的化合物(有磁性)反应_____________。
(2)工业上制粗硅的反应____________。
(3)硫酸铝溶液中加入过量氨水的离子方程式____________。
(4)用稀盐酸清洗铜器皿表面上的铜锈的离子方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com