
将等质量的铜片在酒精灯上加热后,分别放入下列物质中,放置片刻后,使铜片质量增加的是( )
A.硝酸 B.无水乙醇
C.二氧化碳 D.盐酸
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
将5 mol/L的盐酸10 mL稀释到200 mL,从中取出5 mL,这5 mL溶液的物质的量浓度为( )
A.0.5 mol/L B.0.25 mol/L C.0.1 mol/L D.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
1840年,俄国化学家盖斯从大量实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出XkJ热量。已知单质碳的燃烧热为YkJ/mol,则1mol C与O2反应生成CO的反应热ΔH为 ( )
A.-YkJ/mol B.-(10X-Y)kJ/mol
C.-(5X-0.5Y)kJ/mol D.+(10X-Y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间的含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。下列有关“水”电池在海水中放电时的说法正确的是 ( )。
A.正极反应:Ag+Cl--e-===AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)乙醇、水与钠反应的现象分别是________________________________________________________________________________;
其反应方程式分别是________________________________________________________________________________________________________________________________________________。
(2)乙醇在空气中燃烧的现象为________________________________________________________________________;
其反应方程式为________________________________________________________________________。
(3)乙醇催化氧化的化学方程式为________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了确定乙醇分子的结构简式是CH3—O—CH3还是CH3CH2OH,实验室利用右图所示的实验装置,
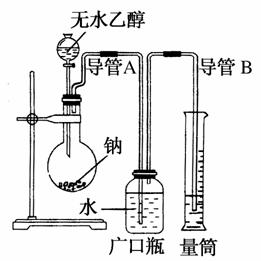
测定乙醇与钠反应(ΔH<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子数目。试回答下列问题:
(1)指出实验装置的错误______________________________________。
(2)若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得氢气的体积将________(填“偏大”“偏小”或“不变”),原因是____________________________________________。
(3)请指出能使实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。

(1)a电极材料为__________,其电极反应式为__________。
(2)电解液d可以是__________,则白色沉淀在电极上生成;也可以是__________,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液
C. NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是__________,在加入苯之前,对d溶液进行加热处理的目的是_______________________________。
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下图所示装置的判断,叙述正确的是( )
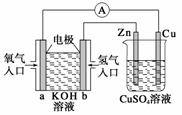
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中的电子流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com