
把2.0 mol CuSO4和1.0 mol
CuSO4和1.0 mol H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度
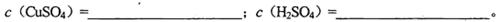
(2)混合液中和的物质的量浓度

(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓
度。c(Fe2+)=_______________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某化学兴趣小组的同学用如图所示装置研究电化学问题。当闭合该装置的电键时,观察到电流计的指针发生偏转。下列有关说法错误的是( )
A、甲装置是原电池,乙装置是电解池
B、当甲中产生0.1 mol气体时,乙中析出固体的质量为6.4 g
C、实验一段时间后,甲烧杯中溶液的pH增大
D、将乙中的C电极换成铜电极,则乙装置可变成电镀装置

查看答案和解析>>
科目:高中化学 来源: 题型:
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:


已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10—16 | 4.0×10—38 | 6.0×10—31 | 6.5×10—18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方法中,不能用于实验室制取氨气的是
A.将烧瓶中的浓氨水加热
B.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
C.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
D.加热试管中的氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
印刷电路板是由塑料和铜箔复合而成,,刻制印刷电路时要用溶液作为“腐蚀液”
溶解铜。
(1)写出该反应的化学方程式:________________________________________;
(2)写出FeCl3与足量的Zn反应的化学方程式:__________________________________;
(3)腐蚀液用久会失效,但可以回收利用:
①若要得到单质铜,下列试剂能实现的是(填序号)
A.氯气 B.铝 C.硝酸 D.稀硫酸 E.铁
②若要将转化为,下列试剂能实现的是(填序号)
A.氯气 B、铝 C、硝酸 D.稀硫酸 E.铁
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C5H10O2的同分异构体甚多,其中符合下列条件:①能发生银镜反应②能与金属钠反应的同分异构体共有(不考虑立体异构)( )
A. 10种 B. 12种 C. 14种 D. 16种
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、N、Q为元素周期表前四周期的五种元素。其中X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍, Q在元素周期表的各元素中电负性最大。元素N的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
| I1 | I2 | I3 | I4 | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
请回答下列问题:
(1)X元素的基态原子中电子占据 种能量不同的原子轨道,属于 区元素,它的外围电子排布图为 。
(2)XZ3分子的立体结构是 ,XZ2分子中中心原子的杂化类型为 ,两者中属于极性分子的是 (写分子式),请简述XZ3和XZ2对应水化物的酸性强弱差异的原因
。
(3)元素N的化合价最可能是________;
(4)M与Q形成的化合物的沸点远高于Y与Q形成的化合物的原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:

氯吡格雷(clopidogrel)是一种用于抑制血小板聚集的药物。以A(C7H5OCl)为原料合成氯吡格雷的路线如下:

完成下列填空:
⑴C中含氧官能团的名称为 ,C→D的反应类型是 。
⑵Y的结构简式为 ,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有 种。
⑶C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环。该反应的化学
程式为 。
⑷由E转化为氯吡格雷时,生成的另一种产物的结构简式为 。
⑸写出A(芳香族化合物)的所有同分异构体的结构简式(包括A本身) 。
⑹
写出由乙烯、甲醇为有机原料制备化合物  的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
CH3CH2OH  CH2=CH2
CH2=CH2
。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4A(s)+3B(g) 2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示正确的 是( )
A.在2 min内的反应速率,用C表示是0.3 mol·L-1·min-1
B.用A表示的反应速率是0.4 mol·L-1·min-1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.分别用B、C、D表示反应速率,其比值是3∶2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com