
| A、是碱性氧化物 |
| B、可置于呼吸面具中提供O2 |
| C、无须密封保存 |
| D、投入水中会使溶液变红色 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
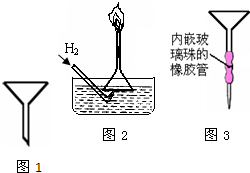 普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.
普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 向0.01mol的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如下图所示:
向0.01mol的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如下图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、达到平衡后,加入催化剂C%增大 |
| B、达到平衡后,若升温平衡向左移 |
| C、m+n<e+f |
| D、达平衡后,若降压平衡向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
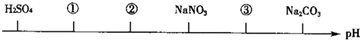
| A、NH4Cl;(NH4)2SO4;CH3COONa |
| B、(NH4)2SO4;NH4Cl;CH3COONa |
| C、(NH4)2SO4;NH4Cl;NaOH |
| D、CH3COOH;NH4Cl;(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
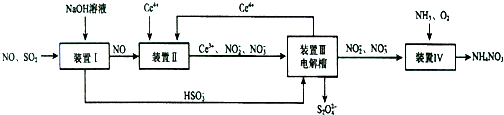
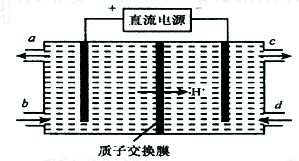
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com