
【题目】已知A是一种相对分子质量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。

请回答下列问题:
![]() 写出A的结构简式______。
写出A的结构简式______。
![]() 、D分子中的官能团名称分别是______、______。
、D分子中的官能团名称分别是______、______。
![]() 物质B可以被直接氧化为D,需要加入的试剂是______。
物质B可以被直接氧化为D,需要加入的试剂是______。
![]() 写出下列反应的化学方程式及其反应类型。
写出下列反应的化学方程式及其反应类型。
![]() ______;反应类型:______。
______;反应类型:______。
![]() ______;反应类型:______。
______;反应类型:______。
![]() ______;反应类型:______。
______;反应类型:______。
【答案】![]() 羟基 羧基 酸性高锰酸钾溶液或酸性重铬酸钾溶液
羟基 羧基 酸性高锰酸钾溶液或酸性重铬酸钾溶液 ![]() 加成反应
加成反应 ![]() 氧化反应
氧化反应 ![]()
![]()
![]() 取代反应
取代反应
【解析】
A是一种相对分子质量为28的气态烃,且A能与水反应,则A是乙烯![]() ,A乙烯和水发生加成反应生成B乙醇(
,A乙烯和水发生加成反应生成B乙醇(![]() ),B乙醇和氧气反应生成C乙醛(
),B乙醇和氧气反应生成C乙醛(![]() ),乙醛进一步发生氧化反应生成D乙酸(
),乙醛进一步发生氧化反应生成D乙酸(![]() ),B乙醇与D乙酸反应生成E乙酸乙酯(
),B乙醇与D乙酸反应生成E乙酸乙酯(![]() ),据此解答。
),据此解答。
A为乙烯,含有碳碳双键,其结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
B为![]() ,含有官能团为羟基,D为
,含有官能团为羟基,D为![]() ,含有官能团为羧基,
,含有官能团为羧基,
故答案为:羟基,羧基;
⑶B为![]() ,含有羟基,可被氧化生成乙酸,所需氧化剂的氧化性较强,一般为酸性高锰酸钾溶液或酸性重铬酸钾溶液,
,含有羟基,可被氧化生成乙酸,所需氧化剂的氧化性较强,一般为酸性高锰酸钾溶液或酸性重铬酸钾溶液,
故答案为:酸性高锰酸钾溶液或酸性重铬酸钾溶液;
⑷反应①是乙烯和水在催化剂条件下发生加成反应生成乙醇,反应方程式为:![]() ,
,
反应②为乙醇的催化氧化,方程式为![]() ,
,
反应④是乙醇与乙酸发生酯化反应生成乙酸乙酯,反应方程式为:![]() ,属于取代反应,
,属于取代反应,
故答案为:![]() ,加成反应;
,加成反应;![]() ,氧化反应;
,氧化反应; ![]() ,取代反应。
,取代反应。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】将amol铁粉加入到含bmol硝酸溶液中,充分反应后铁粉完全溶解,共收集到c L(标况)的NO、NO2混合气体。下列有关说法不正确的是
A. 若反应后产物中只有Fe2+生成,则![]() < a<
< a<![]()
B. 若反应后产物中只有Fe3+生成,则b=3a +![]()
C. 若反应后产物中有Fe2+、Fe3+生成,则![]() <b<6a
<b<6a
D. 若反应后溶液中有dmol H+,则b=3a+d+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。根据材料回答下列问题:
(1)铷位于元素周期表的第________周期________族。
(2)关于铷的下列说法中不正确的是________(填数字序号)。
①与水反应比钠更剧烈 ②Rb2O在空气中易吸收水和二氧化碳
③Rb2O2与水能剧烈反应并释放出O2
④它是极强的还原剂 ⑤RbOH的碱性比同浓度的NaOH弱
(3)现有铷和另一种碱金属形成的合金5 g,与足量水反应时生成标准状况下的气体2.24 L,则另一碱金属可能是_______________(填元素符号)。
(4)铷久置于空气中,最终变成产物是_____________。
A、Rb2O B、Rb2O2 C、Rb2CO3 D、RbHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15 mL苯和少量铁屑。在b中小心加入4.0 mL 液溴。再将b中液溴慢慢加入到a中,充分反应。装置a中发生的主要反应是___;装置d的作用是___。
(2)反应过程中,a外壁温度升高,为提高原料利用率,采取以下措施:
①采用装置c的目的是___。
②利用温度计控制温度,适宜的温度范围为(填序号)___。
A.>156℃ B. 59℃-80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。操作②所需要的玻璃仪器除烧杯外,还需___,滤液用NaOH溶液洗涤的作用是___。
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(4)经过上述分离操作后,粗溴苯中溶解的主要杂质为苯,要进一步提纯,下列操作中必须的是___(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业中,可用FeCl3—HCl溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
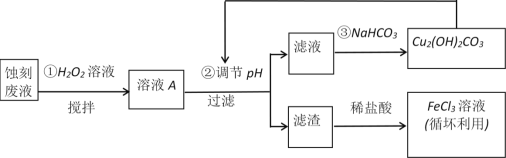
请回答:
(1)把FeCl3溶液蒸干、灼烧,最后得到的主要固体产物是____________。
(2)FeCl3蚀刻液中加入盐酸的目的是______________________________。
(3)步骤①中加入H2O2溶液的目的是(用离子方程式表示)_____________________。
(4)已知:生成氢氧化物沉淀的pH如下表
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是________________。
(5)上述流程路线中,除FeCl3溶液外,还可用于循坏利用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应![]() 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时![]() 和
和![]() 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )

A. 实验c条件下,从反应开始至达到平衡时![]()
B. 实验a条件下,用浓度表示的平衡常数为100
C. 该反应的![]()
D. 比较实验a、c可判断升高温度反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:
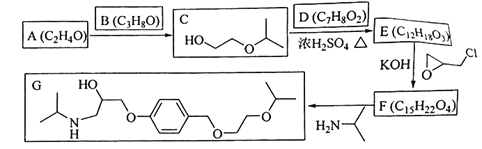
已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物其结构简式为![]() ,关于该有机物下列叙述正确的是
,关于该有机物下列叙述正确的是
A. 不能使酸性KMnO4溶液褪色
B. 不能使溴水褪色
C. 在加热和催化剂作用下,最多能和4 mol H2反应
D. 易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中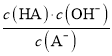 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com