

| 操 作 | 现象及结论 |
| 基于方案一: | |
| 基于方案二: | |
| 操作 | 现象及结论 |
| 基于方案一:取少量烧杯中的溶液于试管中,滴加20℅KSCN溶液,再加入适量氯水。 | 溶液开始不变色,加入氯水后变红色,证明溶液含有Fe2+ |
| 基于方案二:取少量烧杯中的溶液于试管中,加入足量3mol/L的盐酸,再滴加0.1mol/L BaCl2溶液。 | 溶液加盐酸时产生刺激性气体,当加入BaCl2有白色沉淀生成,证明含有SO42- |


科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
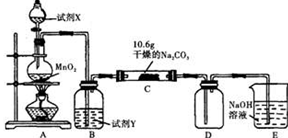
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中。 | |
| 步骤2: | |
| 步骤3: | |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④②⑤③ | B.④①②⑤③ | C.④②①③⑤ | D.⑤②④①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



| A.NaOH溶液 | B.Ca(OH)2溶液 | C.稀硝酸 | D.KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
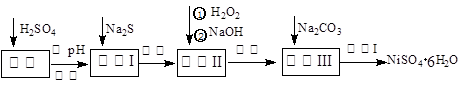
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.② | B.①②④ | C.②④ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.植物油和自来水(蒸馏) | B.水溶液中的食盐和碘(分液) |
| C.CaCO3和CaCl2(溶解、过滤、蒸发) | D.自来水中的杂质(萃取) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | A | B | C | D |
| 实验项目 | 除去KCl中少量的MnO2 | 用10mol/L的盐酸配制100mL0.1mol/L的盐酸 | 用氯化钠溶液制备氯化钠晶体 | 除去CO2气体中的HCl |
| 实验仪器 或装置 | 烧杯、玻璃棒、漏斗 | 100mL容量瓶、玻璃棒、烧杯 |  图1 |  图2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com