已知A、B、D、E、F、G为中学化学中常见的化合物,它们之间有如图所示的转化关系(反应条件及部分产物已略去).A为绿色粉末,含H、C、O、Cu四种元素.常温下,D为无色无味气体.B为黑色粉末,F和E均为有机物,已知F和E的相对分子质量之差等于2.
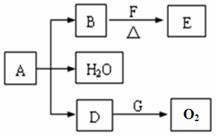
请回答下列问题:
(1)D跟G反应的化学方程式
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
;
(2)B和F在加热条件下反应生成E的化学方程式
CH
3CH
2OH+CuO
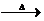
CH
3CHO+H
2O+Cu
CH
3CH
2OH+CuO
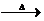
CH
3CHO+H
2O+Cu
;
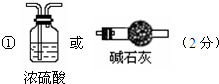
(3)某课外小组设计了下列实验装置,通过测定装置甲和乙中试剂的质量变化,探究A的化学式.
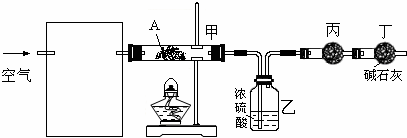
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
②向装置中鼓入空气的目的是
将A分解产生的水蒸气送入盛有浓硫酸的洗气瓶中
将A分解产生的水蒸气送入盛有浓硫酸的洗气瓶中
;丙装置中药品的名称是
无水硫酸铜
无水硫酸铜
,实验时,该药品未见明显变化,证明
A分解产生的水蒸气全部被浓硫酸吸收
A分解产生的水蒸气全部被浓硫酸吸收
;
③如何判断A已完全分解
连续两次加热、鼓气、冷却,称量甲装置的质量,质量差不超过0.1 g,证明A分解完全
连续两次加热、鼓气、冷却,称量甲装置的质量,质量差不超过0.1 g,证明A分解完全
;
④实验测得出如下数据:A受热后完全分解,固体由8.0g变为6.0g,装置乙增重0.9g.写出A的化学式(表示为碱式盐):
Cu3(OH)4CO3或CuCO3?2Cu(OH)2
Cu3(OH)4CO3或CuCO3?2Cu(OH)2
.


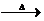 CH3CHO+H2O+Cu
CH3CHO+H2O+Cu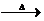 CH3CHO+H2O+Cu
CH3CHO+H2O+Cu



 同步练习强化拓展系列答案
同步练习强化拓展系列答案 则:
则:


 (2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:
(2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:

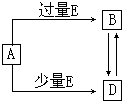 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).