
【题目】下列各组数据中,前者一定比后者大的是( )
A. 相同温度下,pH=10的KOH溶液和pH=10的K2CO3溶液中水电离出的OH-浓度
B. 0.1 mol·L-1(NH4)2Fe(SO4)2溶液与0.1 mol·L-1(NH4)2SO4溶液中NH![]() 浓度
浓度
C. Na2CO3溶液中HCO![]() 和OH-的浓度
和OH-的浓度
D. 纯水在80 ℃和在常温下的pH
【答案】B
【解析】A.KOH抑制水的电离,K2CO3促进水的电离,所以相同温度下,pH=10的KOH溶液和pH=10的K2CO3溶液由水电离出的OH-浓度,后者大,故A错误;B.0.1 mol·L-1(NH4)2Fe(SO4)2溶液与0.1 mol·L-1(NH4)2SO4溶液相比,亚铁离子水解生成的氢离子抑制了(NH4)2Fe(SO4)2溶液中NH4+的水解,使得(NH4)2Fe(SO4)2溶液中NH4+的浓度大于(NH4)2SO4溶液中NH4+浓度,故B正确;C.Na2CO3溶液中碳酸根离子水解生成HCO3-和OH-,水也电离出OH-,所以OH-的浓度大于HCO3-,故C错误;D.纯水时,温度越高水的电离程度越大,氢离子浓度越大,pH越小,所以纯水在80℃和在常温下的pH,前者小,故D错误;故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列对如图所示装置实验现象的描述正确的是( )
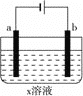
a电极 | b电极 | x溶液 | 实验现象 | |
A | 石墨 | 石墨 | CuCl2 | a极质量增加,b极放出无色气体 |
B | Fe | 石墨 | KNO3 | a极质量增加,b极放出无色气体 |
C | Fe | Cu | CuSO4 | a极质量增加,b极质量减少 |
D | 石墨 | 石墨 | HCl | a、b极都放出无色气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制250 mL 0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是
A. 溶解后溶液尚未冷却就转移至容量瓶中
B. 转移溶液后未洗涤烧杯和玻璃棒
C. 在容量瓶中定容时仰视刻度线
D. 倒转摇匀后,发现液面低于刻度,再补水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示从固体混合物中分离X的2种方案,请根据方案Ⅰ与方案Ⅱ指出下列说法不合理的是

A. 可以选用方案Ⅰ分离NaCl中的I2
B. 方案Ⅰ中X物质不可能是受热易分解的物质
C. 方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3
D. 方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某实验小组利用如图装置合成氯苯(支撑用的铁架台部分省略)并通过一定操作提纯氯苯。
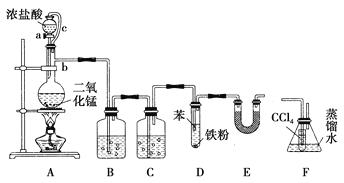
反应物和产物的相关数据列表如下:
密度/g·cm-3 | 沸点/℃ | 水中溶解性 | |
苯 | 0.879 | 80.1 | 微溶 |
氯苯 | 1.11 | 131.7 | 不溶 |
请按要求回答下列问题。
(1)仪器b的名称是________。
(2)A装置中制备Cl2的离子方程式为______________________________。
(3)氯气在通入D之前需净化干燥,则装置C中所加试剂的名称为________。
(4)D中通入氯气后,先看到苯呈黄色,片刻试管液面上方有白雾产生,装置E的作用是________。
(5)为证明氯气和苯发生的是取代反应而不是加成反应,该小组用装置F说明,则装置F置于______之间(填字母),F中小试管内CCl4的作用是________,还需使用的试剂是________。
(6)D中混合物经过滤除铁、加水及NaOH溶液洗涤、无水氯化钙干燥等分离操作后得粗氯苯,粗氯苯中还含有的主要杂质为________,要进一步提纯,下列操作中必需的是________(填入正确选项前的字母)。
A.重结晶 B.分液 C.萃取 D.蒸馏
(7)已知D中加入5 mL苯,经过提纯后收集到氯苯3.0g,则氯苯的产率为________%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 向FeCl3溶液中加入铁粉:Fe3++Fe===2Fe2+
B. 向NaOH溶液中通入过量的CO2气体:OH﹣+CO2=== HCO3-
C. 铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
D. AlC13溶液中加入足量的氨水:Al3++3OH﹣===Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向4L恒容密闭容器中充入2 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是 ( )
A. 反应在前50 s的平均速率为v(PCl3)=0.006 4 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入4 mol PCl3、4 mol Cl2,达到平衡时,则此反应的化学平衡常数为0.025
D. 相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用空气吹出法提取溴的部分流程如下:

下列说法错误的是()
A. ②中可以采用纯碱溶液,发生的反应是:3Br2+6CO32-+3H2O =5Br-+BrO3-+6HCO3-
B. 第③步,需加入氧化性酸,才能将Br-氧化为Br2
C. B溶液颜色要比A溶液深
D. 第④步,采用的是蒸馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖
其中属于电解质的是___________ ,属于强电解质的是_____________。能导电的是___________。
Ⅱ.胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入___________溶液,继续煮沸至____________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为______________________________________________。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做_______________。
③区分胶体和溶液常用的方法叫做__________。
Ⅲ.①FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为_________________________。
②有学生利用FeCl3溶液制取FeCl36H2O晶体主要操作包括:滴入过量盐酸,______、冷却结晶、过滤。过滤操作除了漏斗、烧杯还需要什么玻璃仪器________________。
③高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com