
【题目】Al2O3和SiO2的混合物经过下列流程处理,可以回收其中的铝元素。

试计算:
(1)若铝元素全部转化为铝单质,则Al2O3在原混合物中的质量分数为多少______?
(2)若盐酸恰好溶解其中的Al2O3,则盐酸的物质的量浓度为多少mol/L______?
【答案】50% 3mol/L
【解析】
(1)根据铝原子守恒计算;
(2)根据方程式计算。
(1)根据流程图可知最终得到2.7g单质铝,物质的量是2.7g÷27g/mol=0.1mol,若铝元素全部转化为铝单质,则根据铝原子守恒可知氧化铝的物质的量是0.1mol÷2=0.05mol,质量是0.05mol×102g/mol=5.1g,二氧化硅的质量是5.1g,所以Al2O3在原混合物中的质量分数为![]() ×100%=50%。
×100%=50%。
(2)若盐酸恰好溶解其中的Al2O3,则根据方程式Al2O3+6HCl=2AlCl3+3H2O可知消耗氯化氢是0.05mol×6=0.3mol,则盐酸的物质的量浓度为0.3mol÷0.1L=3.0mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中,化学键类型都相同的是( )
A. CaCl2和NaOH B. Na2O和Na2O2 C. CO2和CS2 D. HCl和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.胶体都有丁达尔现象B.向FeCl3溶液中加入KSCN,最终会看到血红色沉淀
C.氢氧化铁胶体可以透过滤纸D.向硫酸铜溶液中加入一小块金属钠,最终会看到蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
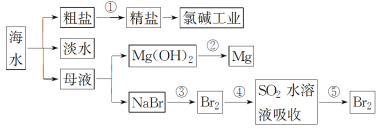
(1)过程①是为了除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,若要除去SO42-,则需要加入的试剂为_____________;若所加的该试剂过量,则可以被后加入的________________除去。
(2)过程②能否一步实现转化?______________(填“能”或“否”),Mg(OH)2与盐酸反应可以得到MgCl2溶液,则该反应的离子方程式为_____________________________________________。
(3)过程④反应的离子方程式为_____________________________________________________。
(4)若用CCl4萃取溴水中的Br2,分液时CCl4层应从分液漏斗的_____________放出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的核外电子排布式为___________,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________,与其为等电子体的分子是___________
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
(3)单质铜及镍都是由____键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是______________________。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为____________。
②若合金的密度为d g·cm–3,晶胞参数a=__________nm。
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3和NH3键角不同,其中键角较大的是____________,其原因是_______________________。且NF3不易与Cu2+形成配离子,其原因是:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某第三周期元素X的气态氢化物的化学式为XH3,则X的最高价氧化物的水化物的化学式为( )
A. H2XO3 B. HXO3 C. H3XO4 D. H2XO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 Ca(OH)2 与 Cl2 反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应。生成 Cl-、ClO-、ClO3- 三种含氯元素的离子,其中 ClO- 、ClO3- 两种离子的物质的量(n)与反应时间
(t)的曲线如图所示。

(1)t1 时,开始有 ClO3-生成的原因是_____。
(2)t2 时,Ca(OH)2 与 Cl2 发生反应的总的化学方程式为___________。
(3)该石灰乳中含有 Ca(OH)2 的物质的量是________mol。
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为![]() a ,则 n(Cl-)=_____mol
a ,则 n(Cl-)=_____mol
(用含 a 的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A. K+、Na+、HCO3-、NO3- B. Na+、SO42-、Cl-、ClO-
C. H+、Mg2+、SO42-、NO3- D. Ag+、K+、NO3-、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com