
| A�� | ����0.1mol•L-1CO32-����Һ��Na+��Al3+��NO3-��S2- | |
| B�� | ��ɫ��Һ��K+��H+��SCN-��SO42- | |
| C�� | $\frac{Kw}{c{��H}^{+}��}$=0.1mol/L����Һ��Na+��K+��HCO3-��NO3- | |
| D�� | ����ˮ�������c��H��=1.0��10-13mol•L-1����Һ�У�Na+��Fe3+��Cl-��CH3COO- |
���� A���������������ӡ�̼������ӷ���˫ˮ�ⷴӦ��
B����������֮�䲻��Ӧ��������ɫ���ӣ�
C������Һ�д��ڴ������������ӣ�̼��������������������ӷ�Ӧ��
D����ˮ�������c��H��=1.0��10-13mol•L-1����Һ�д��ڴ��������ӻ����������ӣ������������������ӡ�����������������ӷ�Ӧ��
��� �⣺A��Al3+��CO32-��S2-֮�䷢��˫ˮ�ⷴӦ������Һ�в��ܴ������棬��A����
B��K+��H+��SCN-��SO42-֮�䲻������Ӧ���Ҷ�����ɫ���ӣ�����Һ���ܹ��������棬��B��ȷ��
C������ҺΪ������Һ����Һ�д��ڴ������������ӣ�HCO3-�����������ӷ�Ӧ������Һ�в��ܴ������棬��C����
D����ˮ�������c��H��=1.0��10-13mol•L-1����Һ�д��ڴ��������ӻ����������ӣ�Fe3+�����������ӷ�Ӧ��CH3COO-�������ӷ�Ӧ������Һ�в��ܴ������棬��D����
��ѡB��
���� ���⿼�����ӹ�����жϣ�Ϊ�߿��ĸ�Ƶ�⣬�����е��Ѷȵ����⣬ע����ȷ���Ӳ��ܴ��������һ��������磺�ܷ������ֽⷴӦ������֮�䣻�ܷ���������ԭ��Ӧ������֮��ȣ���Ӧ��ע����Ŀ���������������磺��Һ������ԣ��ݴ����ж���Һ���Ƿ��д����� H+��OH-����Һ����ɫ������ɫʱ���ų� Cu2+��Fe2+��Fe3+��MnO4-����ɫ���ӵĴ��ڵȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ó���ʯ��ˮ����SO2��CO2 | |
| B�� | ������KMnO4��Һ���ֱ�����ϩ | |
| C�� | ������Cu��OH��2����Һ�������Ǻ������� | |
| D�� | �ü��ȵķ�ʽ����̼���ƺ�̼������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�0.1 mol•L-1 CH3COOH��Һ��pH=3 | |
| B�� | CH3COOH��Һ�ܺ�NaOH��Һ��Ӧ | |
| C�� | ��CH3COOH��Һ�м��뼸��ʯ����Һ����Һ���ɫ | |
| D�� | 0.1 mol•L-1CH3COOH��Һ��������ʵ�飬�ƹ�ϰ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������γ�ˮ����ζ����Ҫ�ɷ� | |
| B�� | ��̼�����ܽ�����Ҵ���������������� | |
| C�� | ������������֬��NaOH��Һ��Ӧ���д����� | |
| D�� | �����������£�CH3CO18OC2H5��ˮ�������CH3CO18OH��C2H5OH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
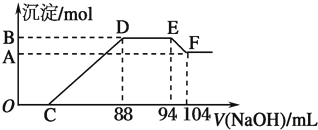
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4+ | B�� | PH3 | C�� | H3O+ | D�� | H2S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol•L-1�� | 0.44 | 0.6 | 0.6 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com