
| A. | 同温、同压下,相同体积的氮气和氦气所含的原子数相等 | |
| B. | 标准状况下,5.6 L以任意比例混合的氯气和氧气所含的原子数为0.5NA | |
| C. | 1 mol氯气和足量NaOH溶液反应转移的电子数为2NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
分析 A.氮气为双原子分子,而氦气为单原子分子;
B.标准状况下气体摩尔体积约为22.4L/mol,氧气和氯气都是双原子分子;
C.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂又是还原剂;
D.常温常压下,不能使用标准状况下的气体摩尔体积计算.
解答 解:A.同温、同压下,相同体积的氮气和氦气具有相同的物质的量,而氮气为双原子分子,稀有气体为单原子分子,所以二者含有的原子数不相等,故A错误;
B.标准状况下5.6L气体的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,氯气和氧气都是双原子分子,所以氯气和氧气以任意比例混合的氯气和氧气所含的原子的物质的量为0.5mol,含有原子数为0.5NA,故B正确;
C.1mol氯气与氢氧化钠溶液反应生成1mol氯化钠和1mol次氯酸钠,转移了1mol电子,转移的电子数为NA,故C错误;
D.不是标准状况下,不能使用22.4L/mol计算混合气体的物质的量,故D错误;
故选B.
点评 本题考查了物质的量的计算,题目难度中等,明确标准状况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与摩尔质量、阿伏伽德罗常数之间的关系,A为易错点,注意稀有气体为单原子分子.


科目:高中化学 来源: 题型:实验题
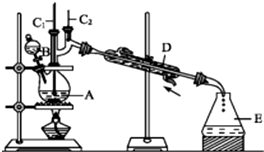 正丁醛是一种化工原料.
正丁醛是一种化工原料.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
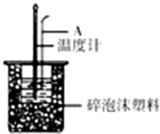 分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )| A. | 稍过量的氢氧化钠是确保盐酸完全反应 | |
| B. | 仪器A的名称是环形玻璃搅拌棒 | |
| C. | 在实验过程中,把温度计上的酸用水冲洗干净后再测量NaOH溶液的温度 | |
| D. | 用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应;通过测定反应过程中所放出的热量可计算中和反应热.
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应;通过测定反应过程中所放出的热量可计算中和反应热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m值为3 | |
| B. | B的转化率为20% | |
| C. | A的平均反应速率为0.1mol•L-1•min-1 | |
| D. | 平衡时反应混合物总物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管未用标准酸液或标准碱液润洗 | |
| B. | 锥形瓶用待测液润洗后加入待测液 | |
| C. | 滴定管在滴定前未进行赶气 | |
| D. | 读数时视线要平视 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 虽然Cu能导电,但Cu是非电解质 | |
| B. | AgCl虽然难溶于水,但AgCl是电解质 | |
| C. | SO3、NH3的水溶液均能导电,所以SO3、NH3均是电解质 | |
| D. | KNO3溶液能导电,所以硝酸钾溶液是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com