
以下四种物质,其中A、B各代表一种离子晶体的晶胞,C代表一种合金的晶胞,D则代表一个由A、B原子组成的团簇分子,其中化学式错误的是( )
|
| A. |
AB | B. |
XY3Z | C. |
EF | D. |
AB |
考点:
晶胞的计算.
专题:
化学键与晶体结构.
分析:
离子晶体和金属晶体中利用均摊法计算晶胞中含有的离子或原子个数确定其化学式,团簇分子中含有的原子个数即是该分子独有的,注意不能用均摊法计算.
解答:
解:A.该晶胞中含有的A离子个数为1,B离子个数=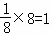 ,A、B离子个数之比是1:1,所以其化学式为AB,故A正确;
,A、B离子个数之比是1:1,所以其化学式为AB,故A正确;
B.该晶胞中含有X离子个数为1,Y离子个数=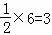 ,Z离子个数=
,Z离子个数=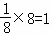 ,所以其化学式为XY3Z,故B正确;
,所以其化学式为XY3Z,故B正确;
C.该晶胞中E原子个数= ,F原子个数═
,F原子个数═ ,E、F原子之比为1:1,所以其化学式为EF,故C正确;
,E、F原子之比为1:1,所以其化学式为EF,故C正确;
D.该团簇分子中所有的原子被其独自占有,所以A原子个数=14,B原子个数=12,所以其化学式为A14B12,故D错误;
故选D.
点评:
本题考查了晶胞的计算,对于离子晶体采用均摊法计算确定化学式,注意团簇分子中所有的原子被该分子独自占有,不能用均摊法计算,为易错点.


科目:高中化学 来源: 题型:
某实验小组只领取下列仪器或用品:铁架台、铁圈、
铁架、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、火柴 、滤纸、漏
、滤纸、漏
斗。只应用上述仪器或用品,不能进行的实验操作是( )
A. 蒸发 B. 萃取 C. 过滤 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
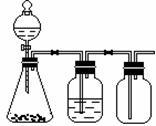
利用下列装置可以完成的实验组合是( )
| 选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
| A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
| B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
| C | Zn 稀硫酸 | 浓硫酸 | H2 |
| D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
共价键、离子键和范德华力都是微粒间的作用力,下列物质:①Na2O2;②SiO2;③石墨;④金刚石;⑤CaCl2;⑥白磷,含有上述结合力中的两种的组合是( )
|
| A. | ①③⑤⑥ | B. | ①③⑥ | C. | ②④⑥ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子为非极性分子 |
| C | 金刚石的熔点低于石墨 | 石墨熔融时除了破坏共价键,还需破坏范德华力 |
| D | HF的沸点高于HCl | H﹣F的键能大于H﹣Cl |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
回答下列问题:
(1)上述反应物中含有一种元素,其基态原子具有八种不同能量电子,写出其基态原子的价电子轨道表示式.
(2)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子.
(3)磷化硼的晶体类型是 ,B原子的杂化方式是 ,每生成1molBP,共形成 4 molB﹣P键.
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P B (填“>”、“<”)
(5)BBr3分子中,B原子采取 杂化,键角为
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
下列方法中可以说明2HI(g)⇌H2(g)+I2(g)已达到平衡的是( )
|
| A. | c(HI):c(H2):c(I2)=2:1:1时 |
|
| B. | 温度和体积一定时,混合气体的颜色不再改变 |
|
| C. | 单位时间内生成n mol H2的同时消耗2n mol HI |
|
| D. | 温度和体积一定时,容器内压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
某同学进行实验,实验装置如右图.其中A、B的成分见下表
| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是 .
(2)实验开始前需要检查气密性,其操作是 分液漏斗中A溶液应该 一次性 加入(填“一次性”或“逐滴滴加”).
(3)完成该实验还需要 (填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平,其作用是 .
(4)请在框图中,画出实验②、③中CO2体积随时间变化的预期结果示意图.

乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率.
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(5)X= ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 .
(6)2号反应中,H2C2O4的反应速率为 .

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com