
1,6﹣已二酸(G)是合成尼龙的主要原料之一,可用含六个碳原子的有机化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F):
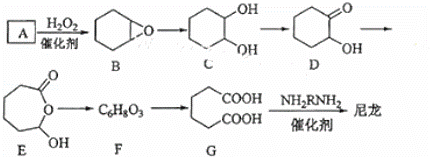
回答下列问题:
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为 .
(2)B到C的反应类型为 .
(3)F的结构简式为 .
(4)在上述中间物质中,核磁共振氢谱出峰最多的是DE,最少的是F.(填化合物代号)
(5)由G合成尼龙的化学方程式为 .
(6)由A通过两步反应制备1,3﹣环已二烯的合成路 .
.
考点: 真题集萃;有机物的合成.
专题: 有机物的化学性质及推断.
分析: 化合物A中含碳87.8%,其余为氢,则碳氢原子个数比为: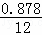 :
: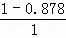 =6:10,又知A含有六个碳原子,故A的化学名称为:C6H10,与双氧水反应生成
=6:10,又知A含有六个碳原子,故A的化学名称为:C6H10,与双氧水反应生成 ,
, 与水发生加成反应生成
与水发生加成反应生成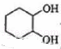 ,
, 发生氧化反应生成
发生氧化反应生成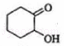 ,
, 再发生氧化反应生成
再发生氧化反应生成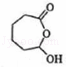 ,
, 再发生氧化反应生成F,F为:
再发生氧化反应生成F,F为: ,
, 再发生氧化反应生成
再发生氧化反应生成 ,
, 与
与 发生缩聚反应生成尼龙,化学式为:
发生缩聚反应生成尼龙,化学式为: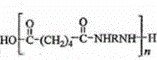 .
.
解答: 解:(1)化合物A中含碳87.8%,其余为氢,则碳氢原子个数比为: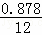 :
: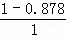 =6:10,又知A含有六个碳原子,故A的化学式为:C6H10,故A的化学名称为:环己烯;
=6:10,又知A含有六个碳原子,故A的化学式为:C6H10,故A的化学名称为:环己烯;
故答案为:环己烯;
(2) 与水发生加成反应生成
与水发生加成反应生成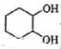 ,故答案为:加成反应;
,故答案为:加成反应;
(3)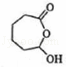 发生氧化反应生成F,F为
发生氧化反应生成F,F为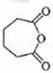 ,故答案为:
,故答案为: ;
;
(4)B的核磁共振氢谱出峰为3,C的核磁共振氢谱出峰为4,D的核磁共振氢谱出峰为6,E的核磁共振氢谱出峰为6,F的核磁共振氢谱出峰为2,
故答案为:DE,F;
(5) 与
与 发生缩聚反应生成
发生缩聚反应生成 ,
,
方程式为: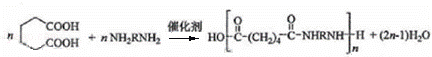 ,
,
故答案为: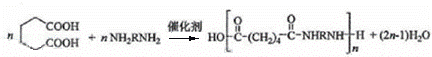 ;
;
(6)

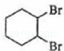
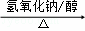
 ,
,
故答案为:

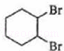
 .
.
点评: 有机推断几乎是2015届高考不变的一个题型,每年2015届高考必考,是热点题型.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
将SO2、H2S、NH3、HCl分别收集于等体积的四个容器中,用导管把四个容器连成一个整体,若使各种气体充分混合(前后条件均相同),混合后容器中的压强与原容器中的压强之比为( )
A. 1:1 B. 1:2 C. 3:4 D. 1:8
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别 10%硫酸体积/mL 温度/℃ 其他物质
Ⅰ 2mL 20
Ⅱ 2mL 20 10滴饱和MnSO4溶液
Ⅲ 2mL 30
Ⅳ 1mL 20 1mL蒸馏水
(1)该反应中氧化剂和还原剂的物质的量之比为
(2)如果研究催化剂对化学反应速率的影响,使用实验 (用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验
(3)对比实验Ⅰ和Ⅳ,可以研究 学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是
查看答案和解析>>
科目:高中化学 来源: 题型:
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.滤出小苏打后,母液提取氯化铵有两种方法:①通入氨,冷却、加食盐,过滤②不通氨,冷却、加食盐,过滤对上述两种方法评价中错误的是()
A. ①析出的氯化铵纯度更高 B. ①的滤液可直接循环使用
C. ②析出的氯化铵纯度不高 D. ②的滤液可直接循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的单质及其化合物有着广泛的用途.请根据元素周期表中第三周期元素相关知识回答下列问题.
完成下列填空:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和简单离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层中p亚层电子数相同的元素名称是硫,磷元素原子最外层电子排布的轨道表示式是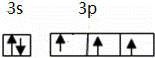 .
.
(3)已知:
化合物 MgO Al2O3 MgCl2 AlCl3
类型 离子化合物 离子化合物 离子化合物 共价化合物
熔点/℃ 2800 2050 714 191
工业制镁时,电解MgCl2而不电解MgO的原因是 ;
制铝时,电解Al2O3而不电解AlCl3的原因是 .
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)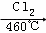 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)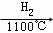 Si(纯)
Si(纯)
在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式: .
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,能证明某物质是强电解质或弱电解质的是( )
|
| A. | 某物质熔化时不导电,则该物质为弱电解质 |
|
| B. | 某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质 |
|
| C. | 某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸 |
|
| D. | 溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
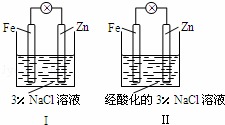
结合图判断,下列叙述正确的是( )
|
| A. | Ⅰ和Ⅱ中正极均被保护 |
|
| B. | Ⅰ和Ⅱ中负极反应均是:Fe﹣2e﹣═Fe2+ |
|
| C. | Ⅰ正极反应是:O2+2H2O+4e﹣═4OH﹣ |
|
| D. | Ⅰ和Ⅱ中分别加入少量KSCN溶液,溶液均变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
-A.-用量筒量取20.0mL 0.500 0 mol•L﹣1 H2SO4溶液于烧杯中,加80 mL配制成0.100 0 mol•L﹣1 H2SO4溶液
-B.-选用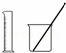 配制100 mL 0.100 0 mol•L﹣1 KMnO4溶液
配制100 mL 0.100 0 mol•L﹣1 KMnO4溶液
-C.-将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
-D.-用1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com