
| A. | x+y<z | B. | B的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增大 |
分析 将容器的容积扩大到原来的三倍,若平衡不移动,A的浓度为$\frac{0.5mol/L}{3}$=0.167mol/L,而达平衡时,测得A的浓度降低为0.15mol/L,可知体积增大压强减小,压强减小时平衡正向移动,以此来解答.
解答 解:A.减小压强平衡正向移动,可知x+y<z,故A正确;
B.平衡正向移动,B的转化率增大,故B错误;
C.由分析可知平衡正向移动,故C正确;
D.平衡正向移动,C的体积分数增大,故D正确;
故选B.
点评 本题考查化学平衡的移动,为高频考点,把握压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意动态与静态的结合判断平衡移动的方向,题目难度不大.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 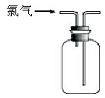 可用于氯气的收集 | B. | 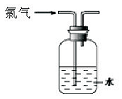 用于除去氯气中少量的氯化氢气体 | ||
| C. | 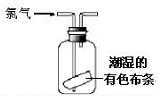 可证明氯气具有漂白性 | D. | 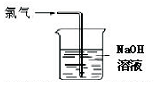 可用于实验室氯气的尾气吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO3→NaCl | B. | SO3→H2SO4 | C. | MgO→Mg(OH)2 | D. | CaCO3→Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 可用过滤的方法将黑色金属氧化物与Na分离开 | |
| C. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| D. | 当光束通过该分散系时,可以看到一条光亮的“通路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )
在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )| A. | 反应速率:a>b>c | B. | 达到平衡时A的转化率大小:b>a>c | ||
| C. | 若T2>T1.则正反应一定是吸热反应 | D. | 达到平衡时,n( AB3)的大小:b>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
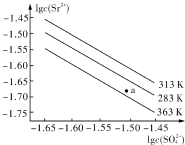
| A. | 温度一定时,KSP(SrSO4)随c(SO42-)的增大而减小 | |
| B. | 三个不同温度中,313K时KSP(SrSO4)最大 | |
| C. | 283K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnS使用量越大,废水中的Cu2+的去除率越高 | |
| B. | 该反应可将工业废水中的Cu2+沉淀完全 | |
| C. | 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 | |
| D. | 该反应的平衡常数K=2.0×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
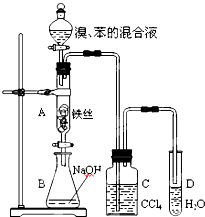 某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.
某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.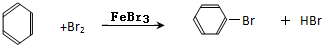 .
.| 向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
| 方法一 | ||
| 方法二 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
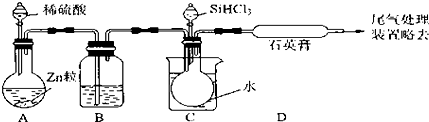
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com