
| A. | 正极附近的 SO4 2- 离子浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 溶液的pH逐渐变小 | |
| D. | 铜片上有 H2 逸出 |
分析 铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极;负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气;溶液中阴离子向负极移动,阳离子向正极移动;由此分析解答.
解答 解:A、该原电池放电时,溶液中阴离子向负极移动,阳离子向正极移动,所以硫酸根离子向负极移动,则负极附近的 SO42- 离子浓度逐渐增大,故A错误;
B、铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极;原电池放电时,电子从负极锌沿导线流向正极铜,故B错误;
C、该原电池中正极上氢离子得电子生成氢气,导致溶液中氢离子浓度降低,pH逐渐变大,故C错误;
D、正极上氢离子得电子生成氢气,所以铜片上有H2逸出,故D正确;
故选:D.
点评 本题考查了原电池原理,难度不大,易错点为:判断溶液中阴阳离子的移动方向.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
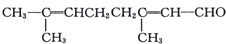 若要检验其中的碳碳双键,实验方法可以是( )
若要检验其中的碳碳双键,实验方法可以是( )| A. | 加入足量银氨溶液,微热,再加入酸性KMnO4溶液 | |
| B. | 加入足量银氨溶液,微热 | |
| C. | 加入足量所制氢氧化铜悬浊液,微热 | |
| D. | 加入酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰升华克服了分子间作用力,没有破坏共价键 | |
| B. | HCl气体溶于水,形成稀盐酸,仅克服分子间作用力 | |
| C. | C60与金刚石互为同素异形体,它们都属于原子晶体 | |
| D. | 乙醇和二甲醚分子都是C2H6O,它们是同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是11或15 | B. | 只能是15 | C. | 只能是7 | D. | 只能是11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com