
| A. | 氢气通过灼热的Cu0粉末 | B. | 二氧化碳通过Na202粉末 | ||
| C. | 铝粉与Fe203粉末发生铝热反应 | D. | 将锌粉投入CuSO4溶液 |
分析 A、氢气通过灼热的CuO生成铜和水;
B、二氧化碳通过Na2O2粉末反应生成碳酸钠和氧气;
C、铝粉与Fe203粉末发生铝热反应,生成单质铁和氧化铝,1mol铝转化成1mol的铁,反应后固体物质质量减少;
D、将锌粉投入CuSO4溶液,生成硫酸锌和单质铜,所以溶液质量减小.
解答 解:A、氢气通过灼热的CuO生成铜和水,最终固体物质质量减小,故A错误;
B、二氧化碳通过Na2O2粉末反应生成碳酸钠和氧气,最终固体物质质量增加,故B正确;
C、铝粉与Fe203粉末发生铝热反应,生成单质铁和氧化铝,1mol铝转化成1mol的铁,反应后固体物质质量减少,故C错误;
D、将锌粉投入CuSO4溶液,生成硫酸锌和单质铜,所以溶液质量减小,故D错误;
故选B.
点评 本题考查了物质性质的分析判断,注意反应前后固体质量的变化分析,掌握化学反应是关键,题目较简单.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
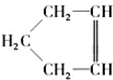 ,可简写为
,可简写为 ,降冰片烯的分子结构可表示为
,降冰片烯的分子结构可表示为 .
. .(任选一种)
.(任选一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
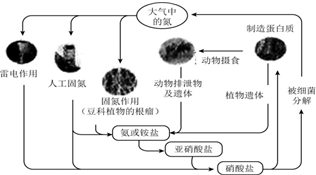
| A. | 上述氮循环中氮元素均被氧化 | |
| B. | 打雷闪电时涉及的一个反应为N2+2O2═2NO2 | |
| C. | 含氮无机物和含氮有机物可相互转化 | |
| D. | 自然界氮循环中氮元素的质量增加了 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨、液氯、干冰、碘化银均为化合物 | |
| B. | 明矾、小苏打、醋酸、次氯酸均为电解质 | |
| C. | 碘酒、牛奶、豆浆、漂白粉均为胶体 | |
| D. | Na2O2、Na2CO3、Na2SiO3、KNO3均为盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃钢是由玻璃纤维和合成树脂组成的材料 | |
| B. | 碳纤维增强复合材料具有韧性好,强度高而质轻的特点 | |
| C. | 硅酸盐材料是新型无机非金属材料 | |
| D. | 有机合成材料易老化,不耐高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定HCl溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.
A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某特定反应的平衡常数只与温度有关 | |
| B. | 催化剂不能改变平衡常数的大小 | |
| C. | 平衡常数发生改变,化学平衡必发生改变 | |
| D. | 化学平衡移动时,平衡常数必改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com