
【题目】草木灰主要成分是K2CO3、KCl、K2SO4和不溶于水的杂质。化学实验组为了制取KCl晶体,设计了如下流程。
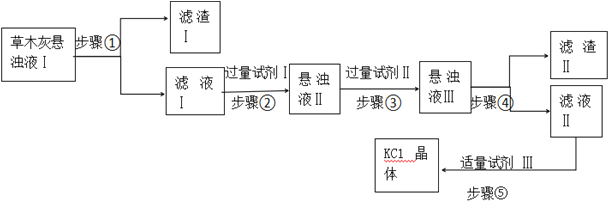 回答下列问题:
回答下列问题:
(1)步骤①中用到的玻璃仪器为:烧杯、_____________。
(2)试剂Ⅲ的名称是__________,步骤⑤操作的名称是________。 可供选择的试剂:BaCl2溶液、Ba(NO3)2溶液、K2CO3溶液、Na2CO3溶液、盐酸。步骤②选择的试剂Ⅰ是___________,发生反应的离子方程式为______________;步骤③选择的试剂Ⅱ是__________,其作用是______________。
【答案】漏斗、玻璃棒 盐酸 蒸发、结晶 BaCl2溶液 Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓ K2CO3溶液 除去过量BaCl2
【解析】
草木灰主要成分是K2CO3、KCl、K2SO4和不溶于水的杂质,为了提纯KCl,过滤除去不溶性杂质,加入试剂Ⅰ是过量BaCl2溶液除去K2CO3、K2SO4,再加入过量试剂Ⅱ是K2CO3,除去过量BaCl2,过滤得到沉淀Ⅱ为BaCO3、BaSO4,滤液Ⅱ中加入试剂Ⅲ为盐酸,除去过量碳酸钾,得到溶液氯化钾溶液,通过加热蒸发,结晶析出得到氯化钾晶体,蒸发到有大量晶体析出,停止加热,靠余热蒸干剩余水得到氯化钾晶体,以此解答该题。
(1)步骤①为过滤操作,用到的玻璃仪器为:烧杯、漏斗、玻璃棒;
(2)试剂Ⅲ应为盐酸,用于除去过量的碳酸钾,步骤⑤由溶液得到晶体,为蒸发、结晶操作,由以上分析可知步骤②选择的试剂Ⅰ是BaCl2溶液,发生反应的离子方程式为Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓;步骤③选择的试剂Ⅱ是K2CO3溶液,其作用是除去过量BaCl2。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质,
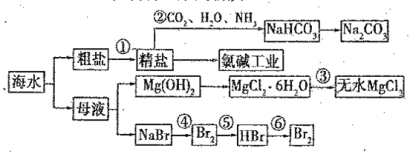
下列说法正确的是( )
A.步骤②中,应先通CO2 ,再通NH3
B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中的 SO42-、Ca2+ 、Mg2+ 等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2 溶液→Na2CO3 溶液→过滤→盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列说法中正确的( )
A.11.7 g氯化钠晶体溶于水中Na+ 的数目为0.2 NA
B.19.6 g硫酸中含有的氧原子数为0.2 NA
C.标况下,1.12 L水中含有的原子数为0.15 NA
D.0.1mol·L-1的MgCl2溶液中,所含Cl- 的数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢钠用途广泛。可广泛应用于医疗、生活、生产中。回答下列问题:
(1)碳酸氢钠能中和胃酸,碳酸氢钠属于____________(填“酸”“碱”“盐”)
(2)碳酸氢钠能与酒石酸配制固体清凉饮料的发泡剂。将发泡剂溶于水发生反应的离子是_________________。
(3)生活中可用碳酸氢钠蒸馒头,用化学方程式解释其原理__________。将碳酸氢钠加入面团中,若理论上生成二氧化碳0.1mol,需要碳酸氢钠的质量是_______克。

(4)碳酸钠和碳酸氢钠是厨房中常见用品,为鉴别它们,取等质量的样品分别加入如图所示装置的气囊中做对比实验,依据_____________现象,推断哪种样品为碳酸氢钠;写出该反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水具有漂白作用和消毒作用。化学研究小组利用下图装置在实验室制备氯水并探究其相关性质。
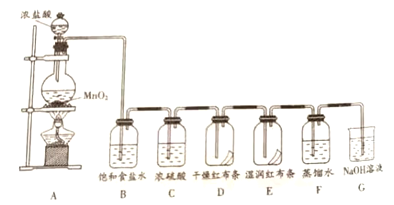
已知:①装置A中发生MnO2 +4HCl(浓)![]() MnCl2 +2H2O+Cl2↑;
MnCl2 +2H2O+Cl2↑;
②次氯酸见光易分解2HClO![]() 2HCl+O2
2HCl+O2![]()
请回答下列问题:
(1)盛放浓盐酸所用仪器的名称是________________。
(2)装置C的作用为___________________。
(3)根据装置D、E中的现象得出结论是____________________。
(4)化学研究小组发现在强光照射下新制氯水产生细小气泡,且浅黄绿色逐渐消失,请预测气泡的成分__________________。
(5)请设计实验测定强光照射下久置氯水中氯元素的质量:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室制取Fe(OH)3胶体的操作是往____(填序号)中逐滴加入___(填序号),继续煮沸至出现红褐色即停止加热。
①沸水 ②NaOH溶液 ③饱和FeCl3溶液
(2)相应的化学方程式是____。
(3)向Fe(OH)3胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是___。
(4)除去胶体中混有的FeCl3和HCl的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1 |
|
实验2 |
|
下列分析正确的是( )
A. 实验1中,白色沉淀a是Al2(CO3)3
B. 实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C. 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某实验小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
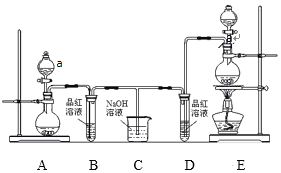
(1)仪器a的名称是 _________。
(2)利用图中E装置进行实验室制备Cl2的离子方程式是_________。
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是_______________。
(4)装置C的作用是_____________。
II.该小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。

其中装置A制取氯气,装置C制取SO2:
(1)甲同学认为若SO2和Cl2反应,则应有Cl-生成,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量_________溶液,有白色沉淀生成。
(2)乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有的试剂是_________。
(3)丙同学认为按乙同学的建议改进实验也不合理,理由是:___________。
(4)丙同学取BaCl2溶液于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中能相互发生反应,反应的化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将70g过氧化钠和氧化钠混合物与98g水充分反应,所得溶液恰好能被含硫酸98g的酸溶液中和,求:
(1)原混合物中过氧化钠和氧化钠的质量分别是多少?___
(2)所得氢氧化钠溶液的质量分数是多少?___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com