
分析 ①五种盐均溶于水,水溶液均为无色,则没有Cu2+、Fe3+;
②D的焰色反应呈黄色,则D中有Na+;
③A的溶液呈中性,B、C、E的溶液呈酸性则含有NH4+、Al3+、Ag+,D的溶液呈碱性则D中含有CO32-,根据阳离子可知D为Na2CO3;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀,则A、C中没有SO42-;
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失,说明C中为Ag+,则E中有Al3+;所以C中为AgNO3;
⑥把A溶液呈中性分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀,则A为BaCl2;由以上分析可知E中含有Al3+,B中含有NH4+,加BaCl2均能生成不溶于稀硝酸的沉淀,则B、E中含有SO42-;所以B、E为(NH4)2SO4、Al2(SO4)3,以此解答该题.
解答 解:①五种盐均溶于水,水溶液均为无色,则没有Cu2+、Fe3+;
②D的焰色反应呈黄色,则D中有Na+;
③A的溶液呈中性,B、C、E的溶液呈酸性则含有NH4+、Al3+、Ag+,D的溶液呈碱性则D中含有CO32-,根据阳离子可知D为Na2CO3;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀,则A、C中没有SO42-;
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失,说明C中为Ag+,则E中有Al3+;所以C中为AgNO3;
⑥把A溶液呈中性分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀,则A为BaCl2;由以上分析可知E中含有Al3+,B中含有NH4+,加BaCl2均能生成不溶于稀硝酸的沉淀,则B、E中含有SO42-;所以B、E为(NH4)2SO4、Al2(SO4)3,
(1)由以上分析可知所含阴离子相同的两种盐的化学式是(NH4)2SO4、Al2(SO4)3,
故答案为:(NH4)2SO4、Al2(SO4)3;
(2)D的化学式为Na2CO3;Na2CO3溶液显碱性的原因是CO32-+H2O?HCO3-+OH-;故答案为:CO32-+H2OHCO3-+OH-;
(3)A和C的溶液反应的离子反应为Ag++Cl-═AgCl↓,Al2(SO4)3和氨水反应的离子方程式是Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Ag++Cl-=AgCl↓; Al3++3NH3•H2O=Al(OH)3↓+NH4+;
(4)检验(NH4)2SO4中所含的阳离子的方法为:取少量(NH4)2SO4于试管中,滴加少量NaOH溶液,在试管口附近放一张湿润的红色石蕊试纸,加热,若试纸变蓝,说明B中阳离子为NH4+;
故答案为:加NaOH加热,如能产生能使湿润的红色石蕊试纸变蓝的气体,证明有NH4+(其他合理方法也可);
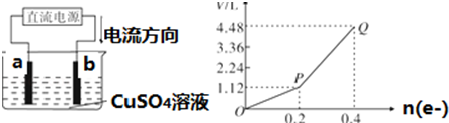
(5)C中为AgNO3,电解时阳极电极方程式为4OH--4e-=O2↑+2H2O,当转移0.2mol电子时,可生成0.05mol氧气,体积为1.12L,
故答案为:4OH--4e-=O2↑+2H2O;1.12.
点评 本题考查物质的检验和推断,为高频考点,把握离子之间的反应及现象推断物质为解答的关键,综合考查元素化合物知识及化学反应原理,综合性较强,题目难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
| 主族族数 周期序数 | ||||||||
| ⑤ | ⑥ | ⑧ | ||||||
| ① | ③ | ④ | ⑦ | ⑩ | ||||
| ② | ⑨ |
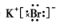 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
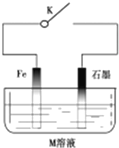
| A. | 常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀 | |
| B. | 关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-=H2↑ | |
| D. | 关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Na+O2═2Na2O | B. | NH4HCO3═NH3↑+H2O+CO2↑ | ||
| C. | NH3+HCl═NH4C1 | D. | H2SO4+2NaOH═Na2SO4+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com