
| A、氧化性:B2>C2>A2 |
| B、在含有C-和A-的溶液中加入B2,C-优先发生反应 |
| C、还原性:B->C->A- |
| D、在含有B2和C2的溶液中加入A-,B2优先发生反应 |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、合金的熔点一般比它的成分金属的熔点高 |
| B、合金的硬度一般比它的成分金属大 |
| C、合金与各成分金属相比,具有许多优良的物理、化学或机械的性能 |
| D、合金在工业上的用途比纯金属更广 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△G>0,△S<0 |
| B、△G<0,△S>0 |
| C、△G>0,△S>0 |
| D、△G<0,△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有最高价元素的化合物不一定具有强的氧化性 |
| B、得电子越多的氧化剂,其氧化性就越强 |
| C、在反应中失去电子的物质被还原,得到电子的物质被氧化 |
| D、氧化还原反应是一种物质首先被氧化,然后另一种物质再被还原的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
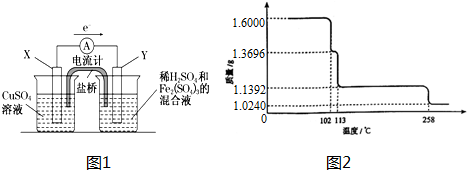
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com