

���� ��1������������״�����÷���������a������Ϊ��Һ©����
��2��װ��A��ͭ��Ũ������ȡ����������װ��B�����������������ֹˮ��������ʵ�飬�ڼ��������½�Mg�Ͷ���������ϣ�Ȼ���ٸ������壬װ��C��þ���Ͷ���������Ӧ��װ��D����ˮ���ռ�N2��װ��E�����ն���������Ȼ������ˮ���ռ�N2��
��3��������֪��װ��B��������ͨ��Ӳ�ʲ�����C��þ�۷�����Ӧ��Ȼ���ٸ������壬��ֹˮ��������װ��C�͵���þ��Ӧ��װ��E���ն�����������������ɵ�һ��������
��4������������ˮ������е���������ͨ����ˮ���ռ������壻
��5���ٵ���þ��ˮ��Ӧ����������þ�Ͱ�����������ʹʪ��ĺ�ɫʯ����ֽ����ɫ��
�ڴ������Һ�����ԣ������м�ˮ�����Һ���ȣ�����NH3���ټ��������CH3COONH4��Һ�����ݹ����Ƿ��ܽ�����жϣ�
��� �⣺��1������������״�����÷���������a������Ϊ��Һ©����
�ʴ�Ϊ����Һ©����
��2��װ��Aͭ��Ũ������ȡ����������Mg����NO2��ȼ�գ�����ΪMg3N2��Mg0��N2��װ��A��Cu��Ũ���ᷴӦ���ɵ�����NO2����װ��B��������ͨ��Ӳ�ʲ�����C��þ�۷�����Ӧ��Ȼ���ٸ������壬��Eװ�ó�ȥ�����NO2��װ��D��ˮ���ռ�N2��������װ�õ�˳��Ϊ��ABCBED��
�ʴ�Ϊ��ABCBED��
��3����װ��B��������ͨ��Ӳ�ʲ�����C��þ�۷�����Ӧ��Ȼ���ٸ������壬װ��B�е���������C�������ֹˮ��������C�������Mg3N2��Ӧ������B�и������������ˮ�Ȼ��ƣ�NO+NO2+2NaOH�T2NaNO2+H2O��2NO2+2NaOH�TNaNO3+NaNO2+H2O����Eװ�ó�ȥ�����NO2������ܻ��е�NO��
�ʴ�Ϊ����ˮ�Ȼ��ƣ���C�������ֹˮ��������C������� Mg3N2��Ӧ������δ��Ӧ���NO2������ܻ��е�NO��
��4������������ˮ������е���������ͨ����ˮ���ռ������壬����ȷ����������N2���ɵ�ʵ������ΪD���Լ�ƿ�е�ˮ������ѹ���ձ��У�
�ʴ�Ϊ��D���Լ�ƿ�е�ˮ������ѹ�뼯��ƿ�У�
��5����ȡC��������Ӧ��Ĺ��������뵽ˮ�в����д̼�����ζ�����壬��������ʹʪ��ĺ�ɫʯ����ֽ�����ɫ��֤�������д���Mg3N2��
�ʴ�Ϊ��ȡC��������Ӧ������뵽ˮ�в����̼�����ζ�����壬�������ʹʪ��ĺ�ɫʯ����ֽ������
��NH3•H2O�ĵ��볣����CH3COOH���볣����ȣ���Ϊ1.75��10-5�����Դ������Һ�����ԣ������м�ˮ�����Һ���ȣ�����NH3���ټ�������� CH3COONH4��Һ�������ܽ⣬˵��MgO��Mg��OH��2���������Һ����NH4+ֱ�ӷ�Ӧ��������NH4+ˮ�������H+��Ӧ��
�ʴ�Ϊ�������м�ˮ�����Һ���ȣ�����NH3���ټ�������� CH3COONH4��Һ�������ܽ⣬˵�� MgO �� Mg��OH��2���������Һ���� NH4+ֱ�ӷ�Ӧ��������NH4+ˮ�������H+��Ӧ��
���� ���⿼�����������ʵ�ʵ��̽��������ʵ��ԭ��������ʵ�����������þ���仯���������ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
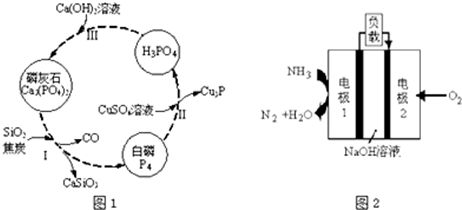
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
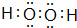 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+��Ba2+��OH-��[Al��OH��4]- | B�� | Fe2+��H+��NO3-��ClO- | ||
| C�� | Al3+��NH4+��Cl-��HCO3- | D�� | K+��Fe3+��SO42-��SCN- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NO2 | B�� | Cl2 | C�� | N2 | D�� | SO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
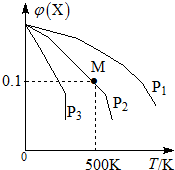 ij���淴ӦΪ2X��g��?3Y��g��+Z��g�������������X�����ʵ����������¶ȹ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ�������
ij���淴ӦΪ2X��g��?3Y��g��+Z��g�������������X�����ʵ����������¶ȹ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ�������| A�� | �����¶ȣ��÷�Ӧƽ�ⳣ��K��С | |
| B�� | ѹǿ��С��P3��P2��P1 | |
| C�� | ƽ�������Ч����ʹ������Է����������� | |
| D�� | �ڸ�������M��Xƽ��ת����Ϊ$\frac{9}{11}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
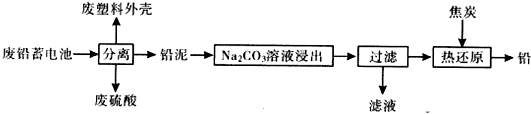
| ���� | Ksp��25�棩 | ��ɫ |
| PbSO4 | 1.8��10-8 | ��ɫ |
| PbCO3 | 1.5��10-13 | ��ɫ |
| PbCrO4 | 1.8��10-14 | ��ɫ |
| BaCrO4 | 1.2��10-10 | ��ɫ |
| Pb��OH��2 | 1.4��10-20 | ��ɫ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com