
| A. | FeCl2→FeCl3 | B. | CuO→Cu | C. | KMnO4→MnO2 | D. | Cl2→NaCl |
分析 加入适当的还原剂才能完成,说明给予物质作氧化剂,在反应中得电子化合价降低,据此分析解答.
解答 解:A.该反应中Fe元素化合价由+2价变为+3价,所以氯化亚铁是还原剂,需要氧化剂氯气等才能实现,故A错误;
B.Cu元素化合价由+2价变为0价,所以CuO是氧化剂,需要还原剂C、氢气等才能实现,故B正确;
C.Mn元素化合价由+7价变为+4价,但不需要还原剂也能实现,如直接加热高锰酸钾,故C错误;
D.Cl元素化合价由0价变为-1价,氯气作氧化剂,但不需要还原剂也能实现,如氯气和NaOH反应,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,明确元素化合价变化与物质性质关系是解本题关键,注意氧化剂和还原剂是同一种物质情况,易错选项是CD.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中毒过程中NO2-表现还原性 | |
| B. | 中毒过程中Fe2+表现氧化性 | |
| C. | 解毒过程中维生素C具有还原性 | |
| D. | 解毒过程中维生素C把Fe2+氧化为Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | Cl2有漂白性 | Cl2能使品红溶液褪色 |
| C | 浓硫酸有脱水性 | 浓硫酸可用于干燥H2和CO |
| D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)═C(金刚石)-1.9KJ可知,金刚石比石墨稳定 | |
| C. | 根据热化学方程式:S(s)+O2(g)═SO2(g)+297.23 kJ,可推知1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和 | |
| D. | 在稀水溶液中 H+(aq)+OH-(aq)═H2O(l)+57.3 kJ,将含0.5 mol H2SO4的浓硫酸与含l mol NaOH的溶液混合时,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
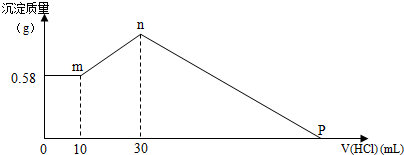
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
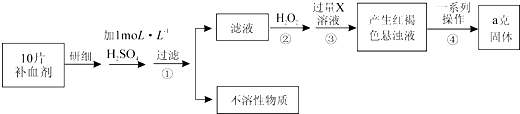
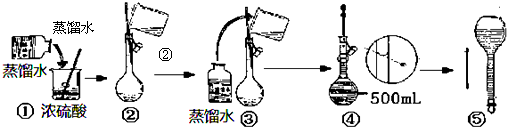
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol/L | B. | 0.1mol/L | C. | 0.2mol/L | D. | 0.3mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com