
【题目】已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g) △H =-Q kJ·mol1(Q>0),则下列说法正确的是( )
2SO3(g) △H =-Q kJ·mol1(Q>0),则下列说法正确的是( )
A.2mol SO2(g)和1mol O2(g)所具有的总能量小于2mol SO3(g)所具有的能量
B.将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.升高温度,平衡向逆反应方向移动,上述热化学方程式中的Q值减小
D.将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2molSO2(g)被氧化
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为______________________________________。
(2)B为0.1 mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因___________________________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入________溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___________________________。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 蒸馏水中;②100 mL 0.2 mol·L-1 AgNO3溶液中;③100 mL 0.1 mol·L-1氯化铝溶液中;④100 mL 0.1 mol·L-1盐酸溶液中,充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为___mol·L-1。
Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 蒸馏水中;②100 mL 0.2 mol·L-1 AgNO3溶液中;③100 mL 0.1 mol·L-1氯化铝溶液中;④100 mL 0.1 mol·L-1盐酸溶液中,充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N≡N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1,逆反应速率v(NH3)=0.4 mol·(L·min)-1
A.全部B.②③④⑤⑥⑦
C.②③④⑤⑦D.③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)已知在448 ℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为________;反应1/2H2(g)+1/2I2(g)
H2(g)+I2(g)的平衡常数K2为________;反应1/2H2(g)+1/2I2(g)![]() HI(g)的平衡常数K3为______________________________________。
HI(g)的平衡常数K3为______________________________________。
(Ⅱ)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为纪念元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、Hg、U”等元素的代言人。回答下列问题:
(1)N在周期表中的位置是__。
(2)下列有关性质的比较,能用元素周期律解释的是__。
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:Na2CO3>NaHCO3
(3)非金属性:Cl>Br,用原子结构解释原因__,用一个离子方程式证明__。
(4)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。
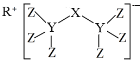
①Y的元素符号为__。②X的氢化物的电子式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL pH=11的NH3·H2O溶液中加入下列物质,对所得溶液的分析正确的是( )
加入的物质 | 对所得溶液的分析 | |
A. | 90mL H2O | 由水电离出的c(H+)=10-10mol·L-1 |
B. | 0.1mol NH4Cl固体 | c(H+)比原NH3·H2O溶液中的大 |
C. | 10mL pH=13的NaOH溶液 | NH3·H2O的电离程度不变 |
D. | 10mL pH=3的盐酸 | 溶液呈中性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)现有下列几组物质,请将其字母按要求填入空格内:
A.CH2=CH—COOH和油酸(C17H33COOH)
B.乙醇和乙二醇
C.丙醇和甲苯
D.![]() 和
和![]()
① 互为同系物的是___________ 。
② 互为同分异构体的是___________ 。
③ 既不是同系物,也不是同分异构体,但可看成是同一类有机物的是___________ 。
(2)现有下列物质,请将其字母按要求填入空格内:
A.淀粉 B.葡萄糖(C6H12O6) C.某些蛋白质 D.油脂
① 遇I2变蓝的是___________。
② 遇浓HNO3呈黄色的是___________。
③ 能发生皂化反应制取肥皂的是___________。
④ 加热条件下能与新制的氢氧化铜反应生成红色沉淀的是___________ 。该物质若发生银镜反应,每3.6g可产生银单质的量是_______。(从下列选项中选出正确答案,并将字母填在空格内)
A. 4.32 g B.8.64g C.0.02mol D.0.06 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______。
(4)A、C、D、E的原子半径由大到小的顺序是_______(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______于F(填“强”或“弱”),并用化学方程式证明上述结论_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产和日常生活中有着广泛的用途。请回答下列问题:
(1)基态铜原子的核外电子排布式为___。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有__![]() 填序号
填序号![]() 。
。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②F、N、O三种元素的第一电离能由大到小的顺序为__![]() 用元素符号表示
用元素符号表示![]()
(3)铜晶体铜原子的堆积方式为面心立方最密堆积。每个铜原子周围距离最近的铜原子数目为___。
(4)某X原子的外围电子排布式为3s23p5,铜与X形成化合物的晶胞如图所示(黑点代表铜原子)。
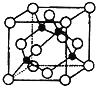
![]() 该晶体的化学式为___。
该晶体的化学式为___。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为NA,则该晶体中晶胞的棱长为__pm(只写计算式![]() 。
。
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液![]() 醋酸二氨合铜(I)、氨水
醋酸二氨合铜(I)、氨水![]() 吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac(Ac表示醋酸根
吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac(Ac表示醋酸根![]()
①如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
②铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___。
③NH3的氮原子的杂化类型为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com