
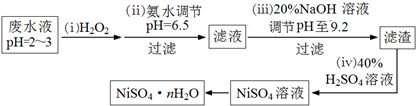
分析 (1)H2O2为二元弱酸,分2步电离;平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)根据在反应过程中先被氧化,后被还原的即化合价先升高,后降低,结合元素的化合价来解答;
(3)碱性氢氧燃料电池工作时,电解质溶液是KOH溶液(碱性电解质),正极是O2得到电子,发生还原反应,正极的电极反应式为:O2+H2O+2e-=HO2-+OH-;
(4)①根据双氧水有强氧化性,能氧化还原性的物质,如Fe2+;
②Cu2+能与氨水反应生成氢氧化铜沉淀,氢氧化铜可用于检验尿糖.
解答 解:(1)H2O2为二元弱酸,分2步电离,电离方程式分别为:H2O2?H++HO2-,HO2-?H++O22-,第二步的电离平衡常数表达式Ka2=$\frac{c({H}^{+})c({{O}_{2}}^{2-})}{c(H{{O}_{2}}^{-})}$,
故答案为:H2O2?H++HO2-;$\frac{c({H}^{+})c({{O}_{2}}^{2-})}{c(H{{O}_{2}}^{-})}$;
(2)①I-的化合价可先升高到0价,再降低到-1价,符合题意;
②Fe3+的化合价只能先降低,然后再升高,不符合题意;
③Cu2+的化合价只能先降低,然后再升高,不符合题意,
④Fe2+的化合价可先升高到+3价,再降低到+2价,符合题意,
故选①④,
故答案为:①④;
(3)碱性氢氧燃料电池工作时,正极是O2得到电子,发生还原反应,电极反应式为O2+H2O+2e-=HO2-+OH-,
故答案为:O2+H2O+2e-=HO2-+OH-;
(4)①双氧水有强氧化性,能氧化Fe2+,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②滤渣中的主要成分是氢氧化铜,氢氧化铜在医疗上的用途是检验尿糖,故答案为:尿糖的检测.
点评 本题是一道综合知识题目,涉及实验操作,电离方程式式、平衡常数、氧化还原反应,原电池,考查学生分析和解决问题的能力,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题
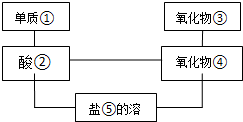 给图中①~⑤选择适当的物质,使有连线的两物质能发生反应.供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉.
给图中①~⑤选择适当的物质,使有连线的两物质能发生反应.供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
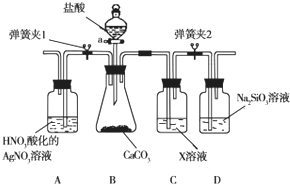 某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是一种单质 | B. | 一定是纯净物 | ||
| C. | 可能是混合物也可能是纯净物 | D. | 一定是同位素组成的不同单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上将NH3与CO2在高温高压下制成[CO(NH2)2] | |
| B. | 空气中的O2和N2在闪电时化合成NO | |
| C. | 豆科植物的根瘤菌把氮气变为NH3 | |
| D. | 工业上用N2和H2来合成NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的结构式:H-O-O-H | B. | C2H4的结构简式:CH2CH2 | ||
| C. | O2-结构示意图: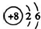 | D. | CCl4的结构式: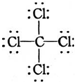 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com