
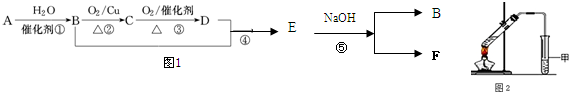
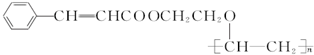 .按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到.
.按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到.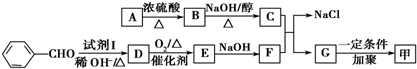
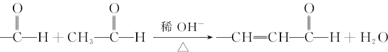
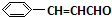 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2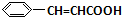 +H2O;
+H2O;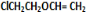 +
+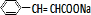 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$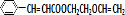 +NaCl.
+NaCl.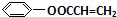 .
. 分析 G通过加聚反应生成高分子化合物甲,由甲的结构可知,G为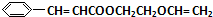 ,试剂Ⅰ可由相对分子质量为26的烃与水,该烃为乙炔,乙炔与水发生加成反应生成乙醛,故试剂Ⅰ是CH3CHO,苯甲醛与乙醛,在稀OH-、加热条件下生成D,由反应信息②可知,D为
,试剂Ⅰ可由相对分子质量为26的烃与水,该烃为乙炔,乙炔与水发生加成反应生成乙醛,故试剂Ⅰ是CH3CHO,苯甲醛与乙醛,在稀OH-、加热条件下生成D,由反应信息②可知,D为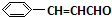 ,D催化氧化生成E,故E为
,D催化氧化生成E,故E为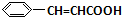 ,E与氢氧化钠反应生成F,故F为
,E与氢氧化钠反应生成F,故F为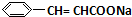 ,F与C反应生成G与NaCl,根据G的结构可知,C为
,F与C反应生成G与NaCl,根据G的结构可知,C为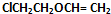 ,A的相对分子质量是80.5,A分子中氧元素的质量分数为19.88%,氧原子数目为$\frac{80.5×19.88%}{16}$=1,碳元素的质量分数为29.81%,碳原子的数目为$\frac{80.5×29.81%}{12}$=2,碳原子与氧原子的相对原子质量为12+16=28,故A含有1个Cl原子,A分子H原子数目为$\frac{80.5-35.5-16-12×2}{1}$=5,故A的分子式为C2H5OCl,A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2:2:1,则A的结构简式为ClCH2CH2OH,由反应信息①可知,B为ClCH2CH2OCH2CH2Cl,B在氢氧化钠醇溶液、加热条件下,发生部分消去反应生成
,A的相对分子质量是80.5,A分子中氧元素的质量分数为19.88%,氧原子数目为$\frac{80.5×19.88%}{16}$=1,碳元素的质量分数为29.81%,碳原子的数目为$\frac{80.5×29.81%}{12}$=2,碳原子与氧原子的相对原子质量为12+16=28,故A含有1个Cl原子,A分子H原子数目为$\frac{80.5-35.5-16-12×2}{1}$=5,故A的分子式为C2H5OCl,A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2:2:1,则A的结构简式为ClCH2CH2OH,由反应信息①可知,B为ClCH2CH2OCH2CH2Cl,B在氢氧化钠醇溶液、加热条件下,发生部分消去反应生成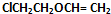 ,据此解答.
,据此解答.
解答 解:G通过加聚反应生成高分子化合物甲,由甲的结构可知,G为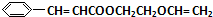 ,试剂Ⅰ可由相对分子质量为26的烃与水,该烃为乙炔,乙炔与水发生加成反应生成乙醛,故试剂Ⅰ是CH3CHO,苯甲醛与乙醛,在稀OH-、加热条件下生成D,由反应信息②可知,D为
,试剂Ⅰ可由相对分子质量为26的烃与水,该烃为乙炔,乙炔与水发生加成反应生成乙醛,故试剂Ⅰ是CH3CHO,苯甲醛与乙醛,在稀OH-、加热条件下生成D,由反应信息②可知,D为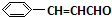 ,D催化氧化生成E,故E为
,D催化氧化生成E,故E为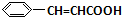 ,E与氢氧化钠反应生成F,故F为
,E与氢氧化钠反应生成F,故F为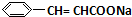 ,F与C反应生成G与NaCl,根据G的结构可知,C为
,F与C反应生成G与NaCl,根据G的结构可知,C为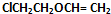 ,A的相对分子质量是80.5,A分子中氧元素的质量分数为19.88%,氧原子数目为$\frac{80.5×19.88%}{16}$=1,碳元素的质量分数为29.81%,碳原子的数目为$\frac{80.5×29.81%}{12}$=2,碳原子与氧原子的相对原子质量为12+16=28,故A含有1个Cl原子,A分子H原子数目为$\frac{80.5-35.5-16-12×2}{1}$=5,故A的分子式为C2H5OCl,A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2:2:1,则A的结构简式为ClCH2CH2OH,由反应信息①可知,B为ClCH2CH2OCH2CH2Cl,B在氢氧化钠醇溶液、加热条件下,发生部分消去反应生成
,A的相对分子质量是80.5,A分子中氧元素的质量分数为19.88%,氧原子数目为$\frac{80.5×19.88%}{16}$=1,碳元素的质量分数为29.81%,碳原子的数目为$\frac{80.5×29.81%}{12}$=2,碳原子与氧原子的相对原子质量为12+16=28,故A含有1个Cl原子,A分子H原子数目为$\frac{80.5-35.5-16-12×2}{1}$=5,故A的分子式为C2H5OCl,A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2:2:1,则A的结构简式为ClCH2CH2OH,由反应信息①可知,B为ClCH2CH2OCH2CH2Cl,B在氢氧化钠醇溶液、加热条件下,发生部分消去反应生成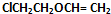 ,
,
(1)由上述分析可知,A为ClCH2CH2OH,
故答案为:ClCH2CH2OH;
(2)试剂Ⅰ可由相对分子质量为26的烃与水,该烃为乙炔,乙炔与水发生加成反应生成乙醛,故试剂Ⅰ是CH3CHO,
B→C是ClCH2CH2OCH2CH2Cl氢氧化钠醇溶液、加热条件下,发生部分消去反应生成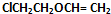 ,
,
故答案为:乙醛,消去反应;
(3)①D→E是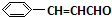 催化氧化生成
催化氧化生成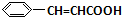 ,反应方程式为:2
,反应方程式为:2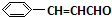 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2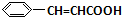 +H2O,
+H2O,
故答案为:2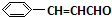 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2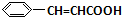 +H2O;
+H2O;
②C与F的反应是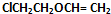 与
与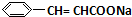 生成
生成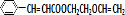 与NaCl,反应方程式为:
与NaCl,反应方程式为: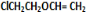 +
+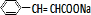 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$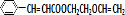 +NaCl,
+NaCl,
故答案为: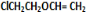 +
+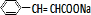 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$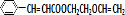 +NaCl;
+NaCl;
(4)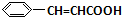 的一种同分异构体,水解产物有两种,说明该异构体含有酯基,一种水解产物能使溴水褪色,故该异构体中含有C=C双键,另一种水解产物在滴加饱和溴水后,有白色沉淀生成,该产物中含有酚羟基,故该异构体含有羧酸酚酯,故该物质的结构简式为
的一种同分异构体,水解产物有两种,说明该异构体含有酯基,一种水解产物能使溴水褪色,故该异构体中含有C=C双键,另一种水解产物在滴加饱和溴水后,有白色沉淀生成,该产物中含有酚羟基,故该异构体含有羧酸酚酯,故该物质的结构简式为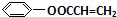 ,
,
故答案为: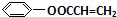 .
.
点评 本题考查有机物的推断,是对有机知识的综合运用,注意根据甲的结构推断其单体,再结合反应信息,利用正、逆推法结合推断,能较好的考查考生的阅读、自学能力和思维能力,难度中等,是热点题型.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | v(A2)=1.5 mol/(L•s) | B. | v(B2)=2.4 mol/(L•s) | C. | v(C)=1.6 mol/(L•s) | D. | v(A2)=6 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2;△H(298K)=-242kJmol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H(298K)=+484kJmol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H(298K)=-242kJmol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H(298K)=-484kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
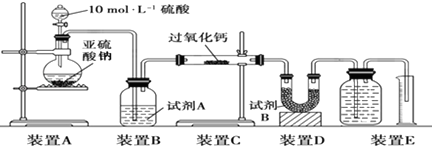
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物:SO2 Mn2O7 NO | |
| B. | 碱性氧化物:Na2O Na2O2 Al2O3 | |
| C. | 盐:Na2CO3 AlCl3 AgCl | |
| D. | 电解质:SO3 Na2O BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-和OH-向阳极定向运动,Cl-被电解,而OH-留在阳极,因此阳极区显碱性 | |
| B. | 阴极的电极反应是:4OH--4e-═O2↑+2H2O | |
| C. | 电解槽内总反应方程式为:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| D. | 向阴阳极分别滴入2滴酚酞,现象是阴极区变成红色,阳极区不变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
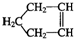 可简写为
可简写为 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为:
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com