
【题目】常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应。用上述两种方法都可制得的氯化物是( )
A.氯化铜B.氯化亚铁C.氯化铁D.氯化铝
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收利用并获得能量,原理如图所示。下列说法正确的是( )
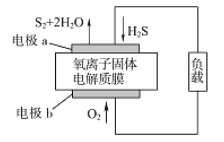
A. 电极b为电池负极
B. 电极a上的电极反应:2H2S+2O2--4e-=S2+2H2O
C. 电极b上的电极反应:O2+4e-+4H+=2H2O
D. 电路中每流过4mol电子,正极消耗44.8LH2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①1 mol羟基所含电子数为10NA;
②一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液中含NH4+的物质的量小于0.5NA;
③1 mol臭氧和1.5 mol氧气含有相同的氧原子数;
④58.5 g的NaCl固体中含有NA个氯化钠分子;
⑤在反应KIO3+6HI==KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA;
⑥标准状况下,2.24 L H2O含有的分子数等于0.1NA;
⑦1 mol 乙烷分子中含有8NA个共价键;
⑧78gNa2O2中含有NA个阴离子;
⑨常温下,7.1 g Cl2与足量NaOH溶液反应转移的电子数约为0.2×6.02×1023;
⑩4.0 g重水(D2O)中所含质子数为2NA。
A. ④⑤⑦⑧⑨ B. ②③⑧⑩ C. 只有③ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列各种共价键的键能:C—H:a kJ· mol-1、O—H:b kJ· mol-1、O=O:c kJ·mol-1、C=O:d kJ·mol-1。写出甲烷气体完全燃烧生成CO2气体和气体水的热化学方程式:_________________________________
(2)火箭中的主要燃料是“肼(也称为联氨)”的液体物质。此化合物的相对分子质量为32。其中,含N的质量分数为87.5%,其余为H元素。则:
①肼的化学式为__________________,其结构式为_____________________________
②此燃料的氧化剂是N2O4气体,若燃烧0.2 mol肼液体放出的热量为 400 kJ,燃烧的产物对大气都无污染(生成的水为液态),则肼与N2O4气体反应的热化学方程式为:__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学史上每一次重大发现都极大地推进了科学的发展。俄国科学家门捷列夫对化学的突出贡献在于( )
A.发现了元素周期律B.提出了原子分子学说
C.揭示了燃烧的本质D.提取了治疟药物青蒿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.20 mol的N2O4气体充入1 L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间 /(s) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) / mol · L-1 | 0.20 | c1 | 0.10 | c2 | c3 | c4 |
c(NO2) / mol · L-1 | 0.00 | 0.12 | 0.20 | 0.22 | 0.22 | 0.22 |
根据本题内容和表中提供数据填空(c1、c2、c3、c4表示相应的浓度),请回答下列各小题:
(1)该反应化学方程式_________________________; 表中c2____c3(填“<”、“>”或“=”)
(2)c4=_______mol · L-1,在0~20 s内NO2的平均反应速率为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,将n(HA)+n(Aˉ)=0.lmol的HA、NaA混合物溶于水形成1L溶液,溶液中c(HA)、c(Aˉ)与pH的关系如图所示。下列叙述中正确的是
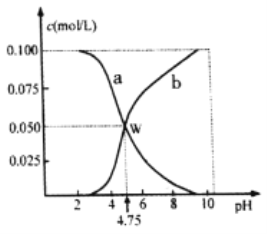
A. a线表示的是c(Aˉ)的变化
B. pH=6 时,c(Na+)+c(HA)>0. 1mol/L
C. 298K时,Aˉ的水解平衡常数(K)的数量级为10-10
D. 若将等物质的量的HA、NaA溶于水中,所得溶液pH恰好为4.75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:

请回答下列问题。
(1)酸浸时FeO与稀HNO3反应的离子方程式_______________________。
(2)将酸浸的尾气循环利用,加入的X气体可以是____________________________。
(3)流程中加入ZnO调pH的目的是__________________________________________。
(4)滤渣2中的成分是___________________。
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol/L,则溶液中S2-浓度大于______mol/L,才生成ZnS沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com