
| A. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属钠投入MgCl2溶液中:2Na+Mg2+═2Na++Mg | |
| C. | 0.1mol/LNaHSO4溶液与0.1mol/LBa(OH)2溶液等体积混合:SO42-+Ba2+=BaSO4↓ | |
| D. | 硅酸钠水溶液中通入过量CO2:SiO32-+2H2O+2CO2═2HCO3-+H2SiO3↓ |
分析 A.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
B.钠与氯化镁溶液中的水反应,不会置换出金属Mg;
C.漏掉了氢离子与氢氧根离子生成水的反应;
D.二氧化碳过量,反应生成碳酸氢钠和硅酸沉淀.
解答 解:A.氯气和水反应生成氯化氢和次氯酸,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故A错误;
B.金属钠投入MgCl2溶液中,反应生成氢气、氯化钠和氢氧化镁沉淀,正确的离子方程式为:2Na+2H2O+Mg2+═H2↑+2Na++Mg(OH)2↓,故B错误;
C.0.1mol/LNaHSO4溶液与0.1mol/LBa(OH)2溶液等体积混合,反应生成硫酸钡沉淀、氢氧化钠和水,正确的离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O,故C错误;
D.硅酸钠水溶液中通入过量CO2,反应生成碳酸氢钠和硅酸,反应的离子方程式为:SiO32-+2H2O+2CO2═2HCO3-+H2SiO3↓,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
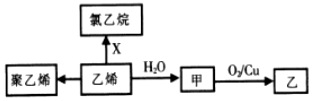
| A. | 1mol聚乙烯含有的原子数目为6NA | B. | CH3OCH3与甲互为同分异构体 | ||
| C. | X为C12 | D. | 甲→乙反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸的水溶液呈酸性,故酸性水溶液一定是酸的水溶液 | |
| B. | Fe3O4可写成FeO?Fe2O3;Pb3O4也可写成PbO?Pb2O3 | |
| C. | 工业上通过电解熔融MgCl2来制取金属镁;也可以通过电解熔融AlCl3来制取金属铝 | |
| D. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物稳定性顺序是HCl>H2S>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 草酸二酯的分子中所有碳原子一定共平面 | |
| B. | 草酸二酯水解后生成醇的分子式为C5H12O | |
| C. | 草酸二酯中苯环上氢原子被一个溴原子取代的有机产物有两种 | |
| D. | 1 mol草酸二酯与足量NaOH溶液反应最多消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的NH4Cl溶液与(NH4)2SO4溶液相比,前者的c(H+)更小 | |
| B. | 0.1 mol•L-l的CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)>0.1 mol•L-1 | |
| C. | pH=9.4,浓度均为0.l mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) | |
| D. | 将少量AgCl分别加入等体积等物质的量浓度的NaBr溶液与KI溶液中,充分反应后,后者的c(Ag+)更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| B. | 为防止食品氧化变质,常在食品包装袋中放入生石灰 | |
| C. | 用加热灼烧的方法可以区分羊毛毛线和腈纶毛线 | |
| D. | 加快开发髙效洁净能源转换技术,缓解能源危机 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
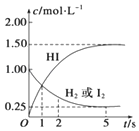 698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:
698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
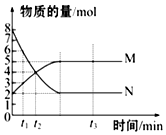 一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
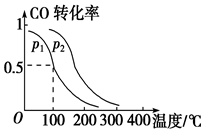 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com