
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 高温或日常用的消毒剂可使禽流感病毒蛋白质变性 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
分析 A.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子;
B、根据蛋白质的理化性质和生理功能发生改变的现象称为蛋白质的变性;
C、铜活泼性比氢弱;
D、重金属盐,能够使蛋白质变性.
解答 解:A.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子,二者原理不相同,故A错误;
B、根据蛋白质的理化性质和生理功能发生改变的现象称为蛋白质的变性.物理因素有:加热、加压、搅拌、振荡、紫外线照射、超声波等;化学因素有:强酸、强碱、重金属盐、三氯乙酸、乙醇、丙酮等,故高温或日常用的消毒剂可使禽流感病毒蛋白质变性,故B正确;
C、铜活泼性比氢弱,不能将氢气还原出,故不能发生析氢腐蚀,故C错误;
D、重金属盐,能够使蛋白质变性,引起人体中毒,可以服用牛奶或者鸡蛋清等解毒,故D错误.
故选B.
点评 本题主要考查有机物的性质、金属的电化学腐蚀和蛋白质的变性等,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
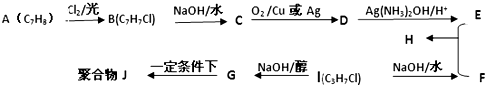
 ,C的官能团名称醇羟基.
,C的官能团名称醇羟基. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
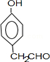
 某研究性学习小组进行如下探究活动:
某研究性学习小组进行如下探究活动:| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与HCl反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Cu与AgNO3反应:2Ag++Cu═Cu2++2Ag | |
| C. | 醋酸与NaOH反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | CuSO4与Ba(OH)2反应:Cu2++2OH-+SO42-+Ba2+═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.65g | B. | 7.3g | C. | 10.95g | D. | 14.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com