
分析 (1)气态SeO3分子Se原子孤电子对数=$\frac{6-2×3}{2}$=0,价层电子对数=3+0=3;SO32-离子中S原子孤电子对数=$\frac{6+2-2×3}{2}$=1,价层电子对数=3+1=4;
(2)NH3中N原子有一对孤电子对,NH4+中N原子上没有孤电子对,NH3中孤电子对与成键电子对排斥力较大;
(3)SiO2晶体中每个Si原子形成4个Si-O键;冰晶体中每个水分子与周围4个水分子形成4个氢键,每个氢键为1个水分子提供$\frac{1}{2}$.
解答 解:(1)气态SeO3分子Se原子孤电子对数=$\frac{6-2×3}{2}$=0,价层电子对数=3+0=3,为平面三角形;SO32-离子中S原子孤电子对数=$\frac{6+2-2×3}{2}$=1,价层电子对数=3+1=4,为三角锥形,
故答案为:平面三角形;三角锥形;
(2)NH3中N原子有一对孤电子对,NH4+中N原子上没有孤电子对,NH3中孤电子对与成键电子对排斥力较大,故NH4+中H-N-H键角比NH3中H-N-H键角大,
故答案为:NH3中N原子有一对孤电子对,排斥力较大,NH4+中N原子上没有孤电子对,排斥力小;
(3)SiO2晶体中每个Si原子形成4个Si-O键,30g SiO2晶体中含Si-O键的物质的量为$\frac{30g}{60g/mol}$×4=2mol,
冰晶体中每个水分子与周围4个水分子形成4个氢键,每个氢键为1个水分子提供$\frac{1}{2}$,则9g冰中含氢键的个数为$\frac{9g}{18g/mol}$×4×$\frac{1}{2}$×6.02×1023mol-1=6.02×1023,
故答案为:2mol;6.02×1023.
点评 本题考查微粒空间构型判断、价层电子对互斥理论、晶体结构等,(3)为易错点,熟记中学常见晶体结构.


科目:高中化学 来源: 题型:选择题
| A. |  :3-甲基-2-戊烯 :3-甲基-2-戊烯 | B. | 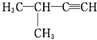 :2-甲基-3-丁炔 :2-甲基-3-丁炔 | ||
| C. | 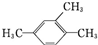 :1,3,4-三甲苯 :1,3,4-三甲苯 | D. | 2,3-二甲基-2-乙基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃中加入稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ | |
| B. | 铝与稀硝酸反应:2Al+6H+═2Al3++3H2↑ | |
| C. | 氯化铝溶液和过量氨水反应:Al3++3NH3•H2O═3NH4++Al (OH)3↓ | |
| D. | 向硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①⑤ | B. | ②⑥ | C. | ①④ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从溴水中提取单质溴时,不能用无水乙醇代替CCl4 | |
| B. | 可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油 | |
| C. | 用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多 | |
| D. | 纸层析实验中,不能将滤纸上的试样点浸入展开剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 贝采里乌斯打破了无机物和有机物的界限 | |
| B. | 苯丙氨酸可以与NaOH溶液或HCl溶液反应形成内盐,内盐的形成是由氢键所致 | |
| C. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 李比希法、钠融法、铜丝燃烧法、元素分析仪均可帮助人们确定有机化合物的元素组成和空间结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
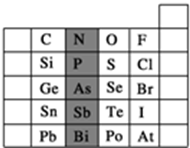 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com