
【题目】下列各基态原子核外电子排布表示正确的是( )
A. 钠原子—1s22s22p7 B. 铜原子—1s22s22p63s23p63d94s2
C. 铁原子—1s22s22p63s23p63d8 D. 氪原子—1s22s22p63s23p63d104s24p6
科目:高中化学 来源: 题型:
【题目】有四种原子:①![]() ②
②![]() ③
③![]() ④
④![]()
(1)其中能与②形成离子键的是___________(填序号)。
(2)①的核外电子数是____;①和②形成的化学键是_____(填“极性键”或“非极性键”)。
(3)②和③互为同位素的本质原因是___________。
(4)④的原子结构示图是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g46%甲酸(HCOOH)水溶液所含的氧原子数为5NA
B. 标准状况下,18g冰水中共价键的数目为NA
C. 56g铁与71gCl2充分反应,转移电子数目为3NA
D. 7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应N2(g)+3H2(g) ![]() 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变(填“大”或“小”),E的大小对该反应的反应热有无影响?。
(2)起始充入2mol·L-1 N2和5.5 mol·L-1 H2 ,经过50 min,NH3的浓度为1mol·L-1 , 则v(N2)=。
(3)已知NH3(g)= NH3 (l) ΔH=-Q kJ·mol-1 , 则N2(g)+3H2(g)= 2NH3 (l)的H=。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生活中常见有机物的说法不正确的是
A. 医用消毒酒精的体积分数为75%
B. 煤干馏的主要产品是煤油
C. 液化石油气和天然气的主要成分不同
D. 常用福尔马林溶液保存动物标本
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X、Y、Z三种液体的近似pH如图,下列判断正确的是___________。

A.X一定是酸或强酸弱碱盐溶液 B.Y一定是90℃时的纯水
C.Y液体一定呈中性 D.Z可能是Na2SiO3溶液
(2)物质的量浓度相同的三种溶液:①NH4Cl②氨水③NH4HSO4,c(NH4+)大小顺序正确的是___________。
A.①>②>③ B.③>①>② C.②>③>① D.③>②>①
(3)比较填空(选填“>"或“ <"或"=”)
①常温下两种溶液:a.pH=4盐酸 b.pH=4NH4Cl溶液,其中水的电离程度大小:a____b。
②已知某可逆反应aA(g)+bB(g)![]() cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b____c+d。
cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b____c+d。

(4)在一定体积的密闭容器中加入1molCO2和1mol H2,进行如下化学反应:CO2(g)+ H2(g) ![]() CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__________________________。
②反应为___________反应(填“吸热”或“放热”)。
③800℃,向容器内充入lmolCO2、lmolH2、lmol CO、lmolH2O,此刻反应的v正_______v逆(填“>"或“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=11
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
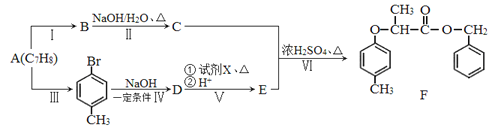
【题目】有机物F是一种香料,其合成路线如图所示:
已知: I. ![]()
II. 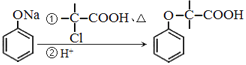
(1)C 的名称为_________________,试剂X的结构简式为_______________,步骤VI的反应类型为_______________________。
(2)步骤II的反应条件为_________________________。
(3)步骤IV 反应的化学方程式为_______________________________。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3 溶液发生显色反应,③能发生水解反应和银镜反应)的E 的同分异构体有___________种,其中核磁共振氢谱峰面积比为6 :2: 2: 1: 1的分子的结构简式为______________________。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取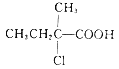 的合成路线图________________________________。(无机试剂一定要选银氨溶液,其它无机试剂任选)
的合成路线图________________________________。(无机试剂一定要选银氨溶液,其它无机试剂任选)
合成路线图示例如下: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着能源与环境问题越来越被人们关注,碳-化学(C1化学)成为研究的热点。“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
(1)将CO2转化成有机物课有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
b.CO2+3H2O![]() CH3OH+H2O
CH3OH+H2O
c.CO2+CH4![]() CH3COOH
CH3COOH
d.2CO2+6H2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
在以上属于人工转化的反应中,原子利用率最高的是_______(填序号)。
(2)CO可用于合成甲醇。在压强0.1MPa条件下,在体积为bL的密闭容器中充入![]() 和
和![]() ,在催化剂作用下合成甲醇:CO(g)+2H2(g)
,在催化剂作用下合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图。
CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图。
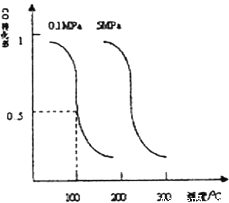
①该反应属于_______反应(填“吸热”或“放热”)。若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是____(填序号)。
a.反应使用催化剂意义不大
b.该反应发生将在很短时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
②100℃时,该反应的平衡常数K=________(用a,b的代数式表示)。
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
①工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g)CH3OH(g) △H1=-90.8kJmol-1
b.2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=-23.5kJmol-
c.CO(g)+H2O(g)CO2(g0+H2(g)△H3=-41.3kJmol
总反应:3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)的△H=___.
②对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是_____(填字母)。
a.n(CH3OH)=n(CH3OCH3)=n(H2O)
b.容器内压强保持不变
c.H2O(g)的浓度保持不变
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
(4)以KOH溶液为电解质,用二甲醚-空气组成燃料,其中负极的电极反应式为_______。
(5)碳化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NOx)在有催化剂的条件下反应的化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com