
【题目】如图装置可用于收集气体并验证其某些化学性质能达到目的是
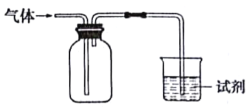
选项 | 气体 | 试剂 | 现象 | 结论 |
A | NH3 | 酚酞试液 | 溶液变红色 | 氨水显碱性 |
B | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
C | C2H4 | 溴水 | 溶液褪色 | C2H4分子中含碳碳双键 |
D | X | KI淀粉溶液 | 溶液变蓝 | X可能是NO2 |
A.AB.BC.CD.D
 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为1L的恒容密闭容器中充入4molA和2molB,发生反应:2A(g)+B(g)![]() 2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/mol | 3 | 3 | 2 |
化学平衡常数 | K1 | K2 | K3 |
A.实验Ⅲ达平衡后,恒温下再向容器中通入2 molA和2 molD,平衡正向移动
B.升高温度能加快反应速率的原理是降低了活化能,使活化分子百分数提高
C.实验Ⅰ达平衡后容器内的压强是实验Ⅲ的0.9倍
D.K3<K2 =K1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)。
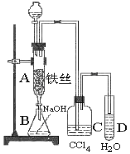
(1)写出A中反应的化学方程式_____。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是____。
(3)C中盛放CCl4的作用是___。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入___,现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻璃是一种重要的传统无机非金属材料。
(1)普通玻璃又称为钠玻璃,试写出生产普通玻璃过程中发生反应的化学方程式:_____________,_______________。
(2)实验室用于盛放碱性试剂的试剂瓶不用磨口玻璃塞的原因是(用离子方程式表示):______________;玻璃试剂瓶不能盛放氢氟酸的原因是(用化学方程式表示):______________。
(3)有一种特殊玻璃为钾玻璃,其热膨胀系数较小,较难熔化,较难受化学药品的侵蚀,可用于制作一般的化学仪器。现以石英砂、苛性钾、熟石灰为原料,熔制钾玻璃,质量比为75:28:37(假定这些原料不含杂质),试用氧化物的形式表示该钾玻璃的组成________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。

(1)物质A的化学式为___,F化学式为___;
(2)B和R在溶液中反应生成F的离子方程式为___;
(3)H在潮湿空气中变成M的实验现象是___,化学方程式为___。
(4)A和水反应生成B和C的离子方程式为___,由此反应可知A有作为___的用途。
(5)M投入盐酸中的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液,当后一种溶液逐滴加入到一定量的前一种溶液中并稍过量,其溶液的导电性(I表示导电能力)与后一种溶液的质量(m)的函数关系符合下图的是
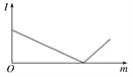
A. 澄清石灰水、碳酸钠溶液
B. 硝酸银溶液、氯化钠溶液
C. 盐酸、氢氧化钠溶液
D. 稀硫酸、氢氧化钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. NaHS溶液水解的方程式为:HS﹣+H2O![]() S2﹣+H3O+
S2﹣+H3O+
B. 向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH﹣+18O2↑
C. 在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl-
D. 用惰性电极电解饱和氯化钠溶液:2Cl﹣+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关注饮用水,保证生活质量。请回答下列问题:
(1)饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将![]() 还原为N2,其化学方程式为: 10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。
还原为N2,其化学方程式为: 10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。
上述反应中,_________元素的化合价升高,则该元素的原子_______(填“得到”或“失去”)电子。当有1mol N2生成时,反应中转移电子的数目为____________。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。工业上将氯气通入石灰乳 [Ca(OH)2]制取漂白粉,化学方程式为:__________________。
(3)KA1(SO4)212H2O的俗名为明矾,因其溶于水生成_____________(化学式)可以吸附杂质,从而达到净水作用。向饱和明矾溶液滴加稀氢氧化钠溶液至过量,用离子方程式和必要文字描述过程现象:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com