
)高炉炼铁过程中发生的主要反应为
Fe2O3(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH (填“>”“<”或“=”)0。
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)= 、CO的平衡转化率= 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
(1) < (2)0.006 mol·(L·min)-1 60% (3)C
【解析】
试题分析: (1)平衡常数表达式中不能用固体或纯液体表示,故K=;由表中数据可知,随着温度升高,平衡常数减小,表明平衡向逆反应方向移动,即正反应为放热反应,故ΔH<0。
(2) Fe2O3(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
起始/(mol·L-1):0.10.1
转化/(mol·L-1):xx
平衡/(mol·L-1):0.1-x0.1+x
K==4.0,x=0.06,v(CO2)==0.006 mol·(L·min)-1,CO转化率=×100%=60%。
(3)A、B项中,增加或减少固体的量不会影响化学平衡移动,故不可以;C项,移出部分CO2,可以增大CO转化率;D项,提高反应温度,平衡向逆反应方向移动,CO转化率减小;E项,减小容器的容积,即加压,平衡不移动,CO的转化率不变;F项,催化剂不影响化学平衡移动,故不影响CO转化率。
考点:平衡常数、平衡移动


 新课标同步训练系列答案
新课标同步训练系列答案科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验装置设计正确、且能达到目的的是 ( )

A.实验Ⅰ:制备金属钠 B.实验Ⅱ:制取氢氧化亚铁并观察其颜色
C.实验Ⅲ:制取少量的氢氧化铝 D.实验Ⅳ:比较两种物质的热稳定性
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第四章检测试卷(解析版) 题型:填空题
)如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,碱色—黄色)

回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是 (填编号);
①A管溶液由红变黄
②B管溶液由红变黄
③A管溶液不变色
④B管溶液不变色
(2)写出A管中发生的反应: ;
(3)写出B管中发生的反应: ;
(4)检验a管中气体的方法是 ;
(5)检验b管中气体的方法是 ;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第四章检测试卷(解析版) 题型:选择题
观察下列几个装置示意图,有关叙述正确的是( )
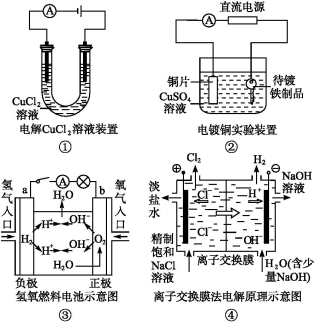
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第二章检测试卷(解析版) 题型:选择题
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g) 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是( )

A.0~20 s内平均反应速率v(N2O5)=0.1 mol·(L·s)-1
B.10 s时,正、逆反应速率相等,达到平衡
C.20 s时,正反应速率大于逆反应速率
D.曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第三章检测试卷(解析版) 题型:实验题
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ | Fe2+ | Cu2+ |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂的目的是 。
(2)最适合作氧化剂X的是 。
A.K2Cr2O7B.NaClO C.H2O2D.KMnO4
(3)加入的物质Y是 。
(4)若不用物质Y而是直接用碱能不能达到目的? (填“能”或“不能”)。若不能,试解释原因 。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第一章检测试卷(解析版) 题型:选择题
分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热的ΔH分别是( )
“嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g) ②2H2(l)+O2(l) |
北京奥运会“祥云”火炬燃料 | 丙烷 (C3H8) | ③C3H8(l)+5O2(g) ④C3H8(g)+5O2(g) |
A.-571.6 kJ·mol-1,-2 221.5 kJ·mol-1
B.-241.3 kJ·mol-1,-2 013.8 kJ·mol-1
C.-285.8 kJ·mol-1,-2 013.8 kJ·mol-1
D.-285.8 kJ·mol-1,-2 221.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.2.2燃料电池试卷(解析版) 题型:选择题
有四种燃料电池:
A.固体氧化物燃料电池 B.碱性氢氧化物燃料电池
C.质子交换膜燃料电池 D.熔融盐燃料电池,
下面是工作原理示意图,其中正极反应生成水的是( )


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com