
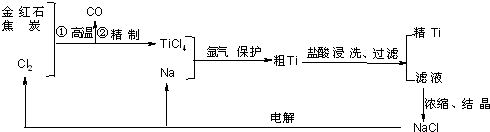
钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料。以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti。工业流程如下:

(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:

从粗TiCl4中精制TiCl4的方法是________(填字母)。
A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液
(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:_________________;阴极产物是__________。
(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:

(4)如图是一个制取氯气并以氯气为原料进行反应的装置,

①装置A中发生反应的化学方程式为_____________________________________。
②在实验室中,某同学欲用如图所示装置净化氯气,则M、N中应盛放的试剂分别是__________、__________。(填试剂名称)

③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯。Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体。试写出装置C中发生反应的化学方程式:_________________________。
(14分)
(1)B(3分)
(2)2Cl- -2e-= Cl2 ↑;钠(或Na)( 各2分)
(3)1,6.1.2H+,2(3分)
(4)
①4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O (2分)
MnCl2+Cl2↑+2H2O (2分)
②饱和食盐水;浓硫酸(各1分)
③TiO2+2C+2
Cl2  TiCl4
+2CO(2分)
TiCl4
+2CO(2分)
【解析】
试题分析:
(1)结合杂质的性质,可以看出熔沸点相差较大,可采用蒸馏的方法;
(2)惰性电极电解熔融NaCl时阳极放电的Cl-,2Cl- -2e-= Cl2 ↑;阴极产物为钠。
(3)根据化合价变化情况可得:分别为1,6.1.2H+,2
(4)①实验室制取氯气的反应4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
②除去氯气中氯化氢用饱和食盐水,干燥可用浓硫酸。
③根据题意可得反应为:TiO2+2C+2
Cl2  TiCl4
+2CO
TiCl4
+2CO
考点:考查化学实验的设计、操作、分析、等相关知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| 物质 | 沸点/°C | 在水中 | 在乙醚中 |
| TiCl4 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 沸点/℃ | 在水中 | 在乙醚中 |
| TiC14 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
| F | 2- 6 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 沸点/℃ | 在水中 | 在乙醚中 |
| TiCl4 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
查看答案和解析>>
科目:高中化学 来源:2012年广东省深圳市高考化学二模试卷(解析版) 题型:解答题

| 物质 | 沸点/°C | 在水中 | 在乙醚中 |
| TiCl4 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com