
| A. | 将2.4g炭完全转化为水煤气,然后再充分燃烧,整个过程放出热量39.35kJ | |
| B. | C的燃烧热为-110.5kJ/mol | |
| C. | H2的燃烧热为-241.8kJ/mol | |
| D. | 由反应③可知,反应过程中转移5mol电子且生成液态水时放出的热量大于604.5kJ |
分析 A.将炭转化为水煤气,再完全燃烧,最终燃烧得到二氧化碳与水,根据盖斯定律,反应放出的热量为C燃烧生成二氧化碳放出的热量;
B.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,一氧化碳不是稳定碳的稳定氧化物;
C.水蒸气不是水在常温下的稳定状态;
D.水蒸气从气态变为液态,需向外界环境放热.
解答 解:A.将炭转化为水煤气,再完全燃烧,最终燃烧得到二氧化碳与水,根据盖斯定律,反应放出的热量为C燃烧生成二氧化碳放出的热量,由①+②可得:C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol,故将2.4g炭转化为水煤气,再完全燃烧,整个过程的△H=-393.5 kJ/mol×$\frac{2.4g}{12g}$=-78.7kJ/mol,故A错误;
B.C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol,一氧化碳不是稳定碳的稳定氧化物,-110.5kJ/mol不是C的燃烧热,C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol,C的燃烧热为393.5kJ/mol,故B错误;
C.H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol,生成液态水放出的热量大于241.8kJ,所以H2的燃烧热大于241.8kJ/mol,故C错误;
D.H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol,每生成1mol水,H的化合价变化为(0→+1)O的化合价变化为(0→-2),反应过程中转移5mol电子,放出热量241.8KJ×$\frac{5}{2}$=604.5kJ,水蒸气从气态变为液态,需向外界环境放热,生成液态水时放出的热量大于604.5kJ,故D正确;
故选D.
点评 本题考查反应热有关计算,关键是对盖斯定律的理解与灵活应用,注意燃烧热的概念应用,题目难度不大.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CH2C12含极性共价键数目为2NA | |
| B. | 含1 mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+的数目大于NA | |
| C. | 4.6g甲苯(C7H8)和丙三醇(C3H8O3)混合物中含H原子数目为0.4NA | |
| D. | 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体桂>碳化硅 | B. | Na>Mg>Al | ||
| C. | NaF<NaCl<NaBr | D. | CI4>CBr4>CCl4>CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积相同 | |
| B. | 非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 | |
| C. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 | |
| D. | 将CO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
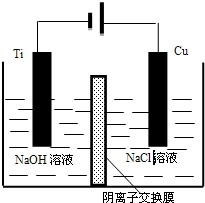 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 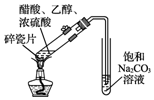 用图装置制取少量乙酸乙酯 | |
| B. | 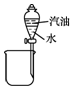 用图装置分离汽油和水 | |
| C. | 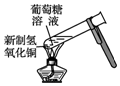 用图装置验证葡萄糖的还原性 | |
| D. | 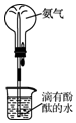 用图装置验证氨气的溶解性和氨水的碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com