
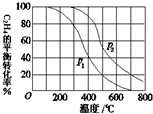
 (1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产.
(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产.| c(CO2) |
| c(CO) |
| 1 |
| 0.25 |
| c(CO2) |
| c(CO) |
| 0.01 |
| x-0.01 |


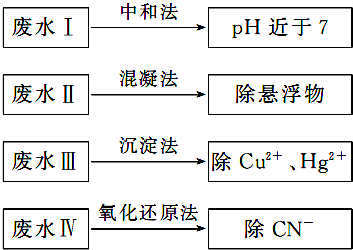
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有AgCl沉淀析出 |
| B、无AgCl沉淀 |
| C、无法确定 |
| D、有沉淀但不是AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| 5n(NO)(mol) | 0.020 | 0.010 | 0.006 | 0.004 | 0.004 | 0.004 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、升高温度能降低反应活化能,所以反应速率加快 |
| C、中和热测定实验中需要用到的玻璃仪器有烧杯、温度计和环形玻璃棒搅拌棒三种 |
| D、等量的CH4在氧气中燃烧放出的热量与形成燃料电池放出的热量一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极反应为4OH--4e-═O2↑+2H2O |
| B、放电时,CO32- 向负极移动 |
| C、电池供应1 mol水蒸气,转移的电子的物质的量为4 mol |
| D、放电时CO32-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| V2O5 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com