
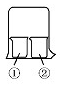
 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( ) | ①中的物质 | ②中的物质 | 预测①的现象 | |
| A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | 淀粉KI溶液浓硝酸无明显变化 | B. | 酚酞溶液浓盐酸无明显变化 | ||
| C. | AlCl3溶液浓氨水有白色沉淀 | D. | 湿润红纸条饱和氯水红纸条褪色 |
分析 A.硝酸具有挥发性、强氧化性,可以将KI氧化为I2,I2遇淀粉变蓝色;
B.浓盐酸具有挥发性,酚酞溶液在酸性条件下为无色;
C.浓氨水具有挥发性,氨水与氯化铝反应生成氢氧化铝;
D.饱和氯水挥发出氯气,氯气与水反应生成HClO,HClO具有漂白性.
解答 解:A.硝酸具有挥发性,挥发出的硝酸进入淀粉KI溶液,硝酸具有强氧化性,可以将KI氧化为I2,I2遇淀粉变蓝色,故A错误;
B.浓盐酸具有挥发性,挥发出的HCl进入酚酞溶液,酚酞溶液在酸性条件下不变色,故B正确;
C.浓氨水具有挥发性,挥发出的氨气,溶于氯化铝溶液,一水合氨与氯化铝反应生成氢氧化铝白色沉淀,故C正确;
D.饱和氯水挥发出氯气,氯气与湿润红纸条接触,氯气水反应生成HClO,HClO具有漂白性,使湿润红纸条褪色,故D正确.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,侧重于学生的分析能力的考查,涉及化学实验、元素化合物性质等,难度不大,明确元素化合物的性质即可分析解答本题,注意“烟”和“雾”的区别.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制备氨气 | 将浓氨水逐滴滴入CaO固体中 |
| B | 制备氯气 | 将浓盐酸逐滴滴入浓硫酸 |
| C | 制备氧气 | 向双氧水中滴入ZnSO4溶液 |
| D | 制备氢气 | 酒精灯加热碳与水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
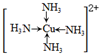
| A. | 澄清透明的溶液中:NH4+、Cu2+、SO42-、Cl- | |
| B. | 含有大量Fe2+的溶液中:K+、Mg2+、C1O-、SO42- | |
| C. | 加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=l×10-12mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| C. | 7.80 g Na2O2与5.85 g NaCl所含阴离子数相等 | |
| D. | 常温常压下,18g H2O含有的氢原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 气体的总物质的量 | |
| D. | 单位时间内生成nmolC的同时消耗2nmolB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com