
Ⅰ. (1)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式。
N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1;
N2(g)+2O2(g)===2NO2(g) ΔH=+68 kJ·mol-1;
2C(s)+O2 (g)===2CO(g) ΔH=-221 kJ·mol-1;
(g)===2CO(g) ΔH=-221 kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
①一定条件下,N2与O2反应生成NO能够自发进行,其原因是________,NO分子中化学键的键能为________kJ·m ol-1。
ol-1。
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=________。
Ⅱ.
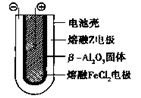
 熔融状态下,
熔融状态下, 钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
2Na+FeCl2  Fe+2NaCl
Fe+2NaCl
放电时,电池的正极反应式为_______ _______________;
_______________;
充电时,________(写物质名称)电极接电源的负极;该电池的电解质为____ __
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下2.24 L H2O中,分子数为0.1NA
B.将1 mol Cl2通入到水中,所得氯水中有:n(HClO)+n(Cl-)+n(ClO-)=2NA
C.常温常压下16 g O2和O3混合气体中,氧原子数为NA
D.7.8 g Na2O2与足量水反应,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室保存下列试剂,其中保存方法和理由描述都正确的是( )
| 选项 | 试剂 | 保存方法 | 理由 |
| A | 钠 | 保存在煤油中 | 防止与空气中水、氧气接触发生反应 |
| B | 液溴 | 密封保存在细口瓶中 | 防止升华 |
| C | 浓硝酸 | 密封保存在铁器中 | 避免见光分解 |
| D | 烧碱 | 存放在磨口玻璃塞的广口瓶中 | 防止与空气中 氧气接触被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,pH=a的某电解质溶液中,插入两支惰性电极 通直流电一段时间后,溶液的pH<a,则该电解质可能是
通直流电一段时间后,溶液的pH<a,则该电解质可能是
A. NaCl B.H2SO4 C.CuCl2 D. Na2SO4
D. Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界 没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2
没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2 O,在II中充入1 mol CO2 和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡
O,在II中充入1 mol CO2 和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡 时,下列说法正确的是( )
时,下列说法正确的是( )
A.容器I、II中正反应速率相同
B.容器I 、III中反应的平衡常数相同
、III中反应的平衡常数相同
C.容器I中CO 的物质的量比容器II中 的少
的少
D.容器I中CO 的转化率与容器II中CO2 的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产和生活密切相关,下列说法正确的是 ( )
A.聚乙烯塑料的老化是因为发生了加成反应
B.煤经过气化和液化等物理变化可转化为清洁燃料
C.合成纤维、人造纤维及碳纤维都属于有机高分子材料
D.利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。下列做法与社会可持续发展理念相违背的是 ( )
A.改进汽车尾气净化技术,减少大气污染物的排放
B.开发利用可再生能源,减少化石燃料的使用
C.研发可降解高分子材料,减少“白色污染”
D.加速开采矿物资源,促进地方经济发展
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,将Na与O2反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.5 mol/L的HCl溶液中和,则该生成物的成分是
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.升高温度,若W的体积分数减小,则此反应ΔH>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是
K=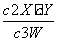
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com