
| A. | 1mol/L氢氧化钠 | B. | 饱和碳酸氢钠 | C. | 1mol/L硫酸亚铁 | D. | 饱和碳酸钠 |
分析 A、把少量过氧化钠投入水中,生成氢氧化钠;
B、把少量过氧化钠投入水中,生成氢氧化钠和饱和碳酸氢钠生成碳酸钠;
C、生成氢氧化钠和氧气,和硫酸亚铁反应生成红褐色沉淀;
D、把少量过氧化钠投入水中,溶剂水的量减少,原饱和溶液.
解答 解:A、把少量过氧化钠投入水中,生成氢氧化钠,仍然是溶液,故A错误;
B、把少量过氧化钠投入水中,生成氢氧化钠和饱和碳酸氢钠生成碳酸钠溶液,无白色沉淀生成,故B错误;
C、生成氢氧化钠和氧气,和硫酸亚铁反应生成红褐色沉淀,不是白色沉淀,故C错误;
D、把少量过氧化钠投入水中,溶剂水的量减少,原饱和溶液,所以有碳酸钠固体析出,故D正确;
故选D.
点评 本题考查的是钠化合物的性质与铁的化合物性质,正确分析反应过程是解本题的关键,经常考查的还有Na2O2、Na投入CuSO4溶液中观察到的现象,难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
 .
.| I1 | I2 | I3 | I4 | … | |
| 电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | 原子半径大小顺序是:Y>X>R | |
| B. | 其气态氢化物的稳定性顺序是:Z>Y>X>R | |
| C. | X、Y、Z中Z的氧化物对应的水化物的酸性最强 | |
| D. | R的气态氢化物与它的含氧酸之间能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
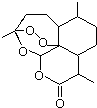 2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图.
2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图. ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)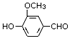 )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
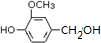 .
.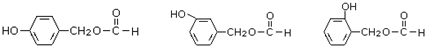 (其中之一).
(其中之一).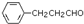 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).已知:羰基α-H可发生反应:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- | B. | SO42- | C. | Na+ | D. | H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
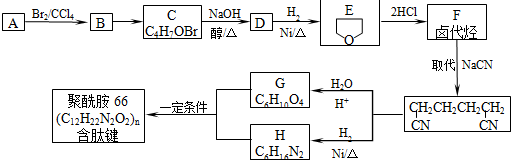
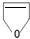 或
或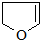 .
.

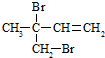

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 二氧化氯消毒液1000mL | |
| 溶质的质量分数 | 80% |
| 密度 | 1.2g/cm3 |
| 强腐蚀性,阴冷,密封储存 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com