
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 待测食醋的体积初读数/mL | 0.02 | 0.03 | 0.00 |
| 待测食醋的体积终读数/mL | 25.01 | 25.04 | 25.02 |
| 氢氧化钠标准液的体积初读数/mL | 0.01 | 0.03 | 0.04 |
| 氢氧化钠标准液的体积终读数/mL | 12.52 | 12.55 | 12.58 |
分析 先分析数据的合理性,求出NaOH体积的平均值,然后根据醋酸与NaOH反应的关系式求出醋酸,最后求出测定食醋的总酸量.
解答 解:3次用去的食醋溶液的体积为:24.99mL;25.01mL;25.02mL,则食醋溶液的体积的平均值为25.01mL.
3次消耗的NaOH溶液的体积为:12.51mL;12.52mL;12.54mL,则NaOH溶液的体积的平均值为12.52mL.
设10mL市售白醋样品含有 CH3COOH Xg,则
CH3COOH~NaOH
60 40
Xg×0.2501 0.1000mol/L×0.01252L×40g/mol
X=0.3004
则样品总酸量3.004g/100mL,
故答案为:3.004.
点评 本题主要考查了中和滴定的计算,试题有一定的灵活性,有一定的难度.


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
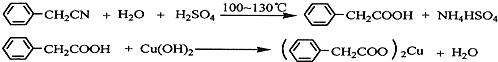
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
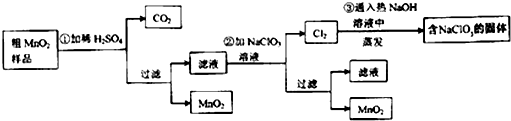
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
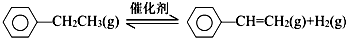
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
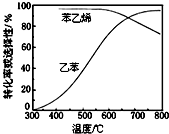
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
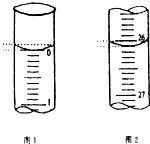 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵变小于零而焓变大于零的反应肯定不能自发发生 | |
| B. | 热化学方程式中△H的值与反应物的用量有关 | |
| C. | 化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变 | |
| D. | 其他条件不变,增大反应物浓度是通过增大活化分子百分数,使化学反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com