
 水的离子积常数Kw与温度t(℃)的关系如图所示:
水的离子积常数Kw与温度t(℃)的关系如图所示:分析 (1)在25℃,则Kw=10-14,根据pH=-lgc(H+)计算pH;
(2)H2A为二元弱酸存在两步电离;
(3)根据0.1L 0.1mo/L的NaA溶液的pH=10判断盐的类型,确定存在的平衡,比较离子浓度的大小;
(3)设出氢氧化钠溶液为x和硫酸溶液的体积为y,根据题中数据列式计算出体积之比.
解答 解:(1)在25℃,则Kw=10-14,根据pH=-lgc(H+)=-lg$\frac{1{0}^{-12}}{0.1}$=11,
故答案为:10-14;11;
(2)已知常温下,0.1mol•L-1的H2A溶液的pH=3,则H2A为二元弱酸存在两步电离,其电离方程式为:H2A?HA-+H+,HA-?A2-+H+;
故答案为:H2A?HA-+H+,HA-?A2-+H+;
(3)由于0.1L 0.1mo/L的NaA溶液的pH=10,说明溶液显示碱性,属于强碱弱酸盐,存在平衡A-+H2O?HA+OH-,H2O?H++OH-,故不水解的钠离子浓度大于A-离子浓度,溶液显碱性,氢离子浓度大于氢氧根离子浓度,
故答案为:A-+H2O?HA+OH-,H2O?H++OH-;c(Na+)>c(A-)>c(OH-)>c(H+);
(4)设氢氧化钠溶液的体积为xL,硫酸溶液的体积为yL,pH=11的NaOH溶液中,氢氧根离子的浓度为:10-3mol/L,pH=4的硫酸溶液中氢离子浓度为:10-4mol/L,
二者混合后溶液的pH=9,溶液酸性碱性,溶液中氢氧根离子的浓度为10-5mol/L,即氢氧化钠过量,即10-3mol/L×xL-10-4mol/L×y=10-5mol/L(x+y),
解得x:y=1:9,
故答案为:1:9.
点评 本题考查了水的电离平衡分析,离子积常数的计算应用,注意离子积是一定温度下的常数,随温度改变,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: )你认为该装置中可以加入苯或CCl4液体.
)你认为该装置中可以加入苯或CCl4液体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

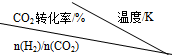 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯水中通入二氧化硫,氯水的漂白性增强 | |
| B. | 氯水中加入NaCl固体,对溶液的pH无影响 | |
| C. | 常温下,pH=2的氯水中:c (Cl-)+c ( ClO-)+c (OH -)=0.01mol•L-1 | |
| D. | 向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-═2CO2↑+Cl -+ClO -+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H2O2分解过程中,Fe2+是反应的催化剂 | |
| B. | 在H2O2生产过程中,要严格避免混入 Fe2+ | |
| C. | H2O2的氧化性比Fe3+强,还原性比Fe2+强 | |
| D. | 在H2O2分解过程中,溶液的pH逐渐下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳元素的单质只存在金刚石和石墨两种同素异形体 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg) | |
| C. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③⑤ | C. | ①②④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填序号)
(1)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填序号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com