
| A. | 标准状况下,22.4L水所含有的原子数目为3NA | |
| B. | 标准状况下,22.4 L H2中含质子数为2NA | |
| C. | 0.1mol•L-1稀硫酸100mL中含有硫酸根个数为0.1NA | |
| D. | 0.1molOH-含NA个电子 |
分析 A、标况下水为液态;
B、求出氢气的物质的量,然后根据氢气中含2个质子来分析;
C、求出硫酸的物质的量,然后根据1mol硫酸能电离出1mol硫酸根来分析;
D、氢氧根中含10个电子.
解答 解:A、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、标况下22.4L氢气的物质的量为1mol,而氢气中含2个质子,故1mol氢气中含2NA个质子,故B正确;
C、溶液中硫酸的物质的量n=CV=0.1mol/L×0.1L=0.01mol,而1mol硫酸能电离出1mol硫酸根,故溶液中含有的硫酸根的个数为0.01NA个,故C错误;
D、氢氧根中含10个电子,故0.1mol氢氧根中含NA个电子,故D正确.
故选BD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
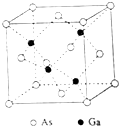 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
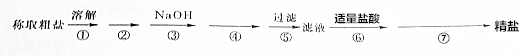
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
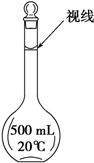 实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑦ | B. | ②③⑥⑦ | C. | ④⑤⑥⑦ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到冷浓硝酸中:2Al+6H+=2Al3++3H2↑ | |
| B. | 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com