
在密闭容器中发生反应:aX(g)+bY(g)
 cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平
cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平
衡状态的1.8倍。下列叙述正确的是
A.平衡向正反应方向移动 B.(a+b)>(c+d)
C.Z的体积分数变大 D.X的转化率变小
科目:高中化学 来源: 题型:
现有原子序数依次相差1,且由小到大排列的A、B、C、D、E五种短周期元素。下列有关这五种元素的叙述正确的是( )
①若A的最高价氧化物对应的水化物是强碱,则E的最高价氧化物对应的水化物是强酸
②若A的单质既能与强酸又能与强碱反应且都放出氢气,则这五种元素在同一周期
③若A的阳离子比E的阴离子少8个电子,则D一定是非金属元素
④若D的最高价氧化物对应的水化物是强酸,则E的单质在常温下为气态
⑤这五种原子的原子半径关系一定为:A>B>C>D>E
A.②③④ B.①②③
C.③④⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与平衡移动无关的是
A.实验室排饱和盐水收集氧气 B.打开汽水瓶后,瓶中马上泛起大量气泡
C.热纯碱溶液去油污能力更强 D.NH4Cl(s)  NH3(g)+HCl(g)
NH3(g)+HCl(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变 化如表:
化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。
(2)如图所示,表示NO2变化曲线的是________。用O2表示从0 s~2 s内该反应的平均速率v=________________。
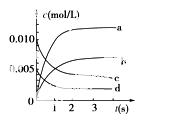
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c .v逆(NO)=2v正(O2) d.容器内密度保持不变
.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)2NH3(g)+
CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是 ( )
| 温度 | 平衡浓度(mol·L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A(g)+B(g)  C(g)+D(g)。判断该反应是否达到平衡的依据为__________(填正确选项前的字母):
C(g)+D(g)。判断该反应是否达到平衡的依据为__________(填正确选项前的字母):
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
加热N2O5,依次发生的分解反应为①N2O5(g)  N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)  N2O(g)+O2(g)。
N2O(g)+O2(g)。
在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol,
则t ℃时反应①的平衡常数为 ( )
A.10.7 B.8.5 C.9.6 D.10.2
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产纯碱的工艺流程示意图如下:
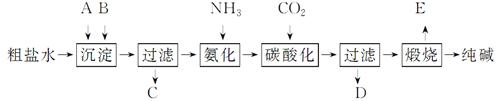
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A ,B 。
(2)实验室提纯粗盐的实验操作依次为:
取样、 、沉淀、 、 、冷却结晶、 、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是______。碳酸化时没有析出碳酸钠晶体,其原因是______。
(4)碳酸化后过滤,滤液D最主要的成分是_____
(填写化学式),检验这一成分的阴离子的具体方法是____。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为: 。滤液D加石灰水前先要加热,原因是 。
(6)产品纯碱中含有碳 酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:________(注明你的表达式中所用的有关符合的含义)。
酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:________(注明你的表达式中所用的有关符合的含义)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com