
| A.0.2 mol?L-1?S-1 | B.0.4 mol?L-1?S-1 |
| C.0.6 mol?L-1?S-1 | D.0.8 mol?L-1?S-1 |
科目:高中化学 来源: 题型:
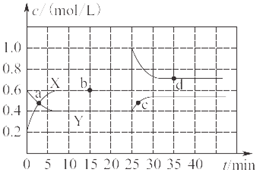 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图所示.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图所示.| 10 |
| 9 |
| 10 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO.2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
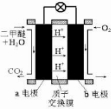 为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为查看答案和解析>>
科目:高中化学 来源: 题型:
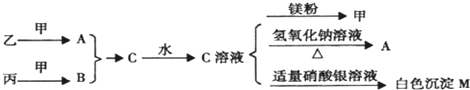
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
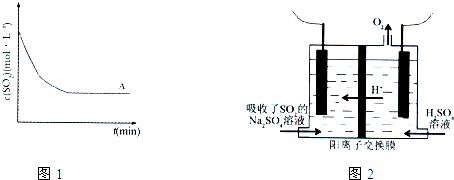
| 方法1 | 用氨水将SO2转化为(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法2 | 用活性炭吸附法处理SO2 |
| 方法3 | 用Na2SO4溶液吸收SO2,再进行电解得到S单质 |
| t(min) 浓度(mol?L-1) |
0min | 1min | 2min | 3min | 4min | 5min | 6min |
| c(SO2) | 0.054 | 0.034 | 0.018 | 0.010 | 0.008 | 0.006 | 0.006 |
| c(O2) | 0.032 | 0.022 | 0.014 | 0.010 | 0.009 | 0.008 | 0.008 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com