
下列与金属腐蚀有关的说法中,不正确的是
A.钢铁在潮湿空气中生锈属于电化学腐蚀
B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀
C.金属腐蚀的本质是金属原子失去电子被氧化的过程
D.铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应
科目:高中化学 来源:2014-2015学年河南省天一高三上学期大联考化学试卷(解析版) 题型:实验题
(10分)二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃。用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如下图所示:
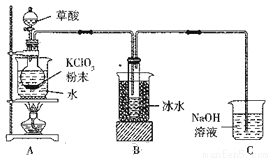
(1)装置A中还应安装的玻璃仪器是____,装置B用冰水浴的原因是________.
(2)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:________________.
(3)①实验过程中,装置C中少量的ClO2与NaOH溶液反应产生两种钠盐,且物质的量之比为1:1,其中一种为NaClO2,写出装置C中生成这两种钠盐的离子方程式:_____________________________。
②饱和溶液在温度低于38℃时析出晶体NaClO2.3H2O,在温度高于38℃时析出晶体NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
a.____________________;b________________________;c.洗涤;d.干燥。
(4)还可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备ClO2更受欢迎,其主要原因是______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三上学期期末理综化学试卷(解析版) 题型:填空题
(选考)【化学——物质结构与性质】(15分)
W、Q、R、X、Y、Z六种元素的原子序数逐渐增大。已知W原子1s轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn。请回答下列问题:
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是 ,该分子中含有____个 键。
键。
(2)Z原子的核外电子排布式为 ;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH3之间的化学键为 。
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于____晶体;W、Q、X三种元素之间可以形成多种化合物,其中邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,理由是 。邻甲基苯甲醛分子中碳原子轨道的杂化类型为 。1 mol 苯甲醛分子中σ键为 mol。
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。

该晶体中阳离子和阴离子个数比为____,晶体中每个Xn-被 个等距离的C+离子包围。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
下述实验方案能达到实验目的的是
编号 | A | B | C | D |
实验 方案 | |
|
|
|
实验 目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A.溶质水解反应:HCO3- +H2O H3O++CO32-
H3O++CO32-
B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C.微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D.微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:填空题
(10分)X、Y、Z、Q、W、R六种短周期元素原子序数依次增大,化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13,工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答以下问题:
(1)Q的原子结构示意图为 。
(2)Y元素的单质能发生如图所示的转化,则Y元素为 (用元素符号表示)。在甲溶液中通入足量YZ2气体,所得溶液呈碱性,原因是 (用离子方程式和必要的文字说明)。

(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为:
②Q、W两种元素金属性的强弱为Q W(填“>”、“<”);
下列表述中证明这一事实的是 。
a.Q的单质的熔点比W单质低
b.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
c.W的原子序数大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:选择题
X、Y、Z、M、W为五种短周期元素。它们在周期表的相对位置如下表:
M | |||||||
X | Y | Z | |||||
W |
则下列说法正确的是:
A.Y、M形成的气态化合物在标准状况下的密度为0.76 g.L-1
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质一定是原子晶体
D.XZ2、X2M2、W2Z2均为直线型的共价化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省红河州高三统一检测理综化学试卷(解析版) 题型:填空题
【化学-选修2:化学与技术】(15分)
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成的。由蛇纹石制取碱式碳酸镁的实验步骤如下:

(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是_ 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),则沉淀物A的主要成份为 ,沉淀物B的主要成份为 。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀的PH值 | 1.5 | 3.3 | 9.4 |
(3)若要从沉淀物A中提取出某种可用于工业冶炼铝的原料,应先向A中加入 溶液(填物质化学式)再过滤,然后向滤液中通入过量CO2,过滤、灼烧。请写出通入CO2时发生反应的离子方程式 。
(4)为确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,称取18.2g样品完全分解后,测得产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中a=______、b=_______、c=______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10°C,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用同浓度的盐酸中和,消耗盐酸的体积相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com