
【题目】Ba(NO3)2可用于生产烟花。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用某种钡泥[主要含有BaCO3、Ba(FeO2)2、极少量CuCO3等]制取Ba(NO3)2晶体,其部分工艺流程如下:
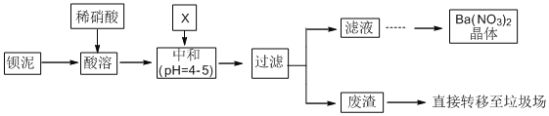
已知:Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7。
(1)酸溶时不使用浓硝酸的原因是_________________________________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为__________________。
(3)该厂结合本厂实际,中和选用的X为____________(填化学式);中和使溶液中______(填离子符号)的浓度减少(中和引起的溶液体积变化可忽略)。
(4)滤液得到Ba(NO3)2晶体的操作依次为_________、_________、过滤。
(5)该厂生产的Ba(NO3)2晶体含有少量Cu2+。化学上通过惰性电极电解法富集Cu时,发现电解装置的阴极还有少量使红色石蕊试纸变蓝的气体生成。生成该气体的电极反应为______________________________。
(6)Ba2+致死量为355mg/kg。误食Ba2+可以服用MgSO4溶液解毒,涉及到的离子反应方程式为___________;为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是__________________。
【答案】浓HNO3易挥发、分解 Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O BaCO3 Fe3+、H+ 蒸发浓缩 冷却结晶 NO3-+ 6H2O +8e-=NH3 ↑+ 9OH- Ba2+ + SO42- = BaSO4 ↓ 洗涤废渣并回收洗涤液
【解析】
BaCO3含少量CuCO3、Ba(FeO2)2等杂质,其中Ba(FeO2)2中钡元素为+2价,铁元素为+3价,加入硝酸,在容器中充分溶解得到溶液,此溶液中含有钡离子、铜离子、三价铁离子,可加入X碳酸钡,调节溶液pH=4~5,使铁离子、铜离子水解生成Fe(OH)3沉淀、Cu(OH)2沉淀,过滤后废渣为Fe(OH)3、Cu(OH)2,滤液中主要含有硝酸、硝酸钡,经蒸发浓缩,冷却结晶,过滤可得到硝酸钡晶体,据此分析解答。
BaCO3含少量CuCO3、Ba(FeO2)2等杂质,其中Ba(FeO2)2中钡元素为+2价,铁元素为+3价,加入硝酸,在容器中充分溶解得到溶液,此溶液中含有钡离子、铜离子、三价铁离子,可加入X碳酸钡,调节溶液pH=4~5,使铁离子、铜离子水解生成Fe(OH)3沉淀、Cu(OH)2沉淀,过滤后废渣为Fe(OH)3、Cu(OH)2,滤液中主要含有硝酸、硝酸钡,经蒸发浓缩,冷却结晶,过滤可得到硝酸钡晶体。
(1)酸溶时不使用浓硝酸的原因是浓HNO3易挥发、分解;
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3反应生成硝酸钡、硝酸铁和水,反应的化学方程式为Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)该厂结合本厂实际,中和选用的X必须能消耗过量硝酸并使铁离子沉淀而除去,且不引入新的杂质,可为BaCO3;中和使溶液中Fe3+、H+的浓度减少;
(4)滤液得到Ba(NO3)2晶体的操作依次为蒸发浓缩、冷却结晶、过滤;
(5)电解装置的阴极还有少量使红色石蕊试纸变蓝的气体生成,则气体显碱性为氨气,生成该气体的电极反应是硝酸根离子得电子产生氨气,电极反应式为NO3-+ 6H2O +8e-=NH3 ↑+ 9OH-;
(6)误食Ba2+可以服用MgSO4溶液解毒,钡离子与硫酸根离子反应产生难溶于酸的硫酸钡,涉及到的离子反应方程式为Ba2+ + SO42- = BaSO4 ↓;为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是洗涤废渣并回收洗涤液,避免引起污染。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知断裂1 mol共价键所需要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列对H2(g)+I2(g)![]() 2HI(g)的反应类型判断错误的是( )
2HI(g)的反应类型判断错误的是( )
A.放出能量的反应B.吸收能量的反应
C.氧化还原反应D.可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,他们之间有如图所示的转化关系,请回答下列问题:
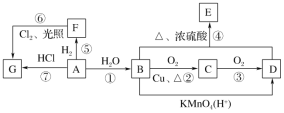
(1)A中官能团的名称为____________,B中官能团的电子式为____________。
(2)在F的同系物中最简单的有机物的空间构型为____________。
(3)写出下列编号对应反应的化学方程式,并注明反应类型:
④___________________________________________________,___________________;
⑦___________________________________________________,___________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明的一种可控锂水电池的工作原理如图所示。下列有关说法不正确的是( )

A.电池工作时,锂离子向正极移动B.电池总反应为![]()
C.有机电解质可用水溶液代替D.该装置不仅可提供电能,还可得到清洁的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种可充电的锂离子电池充放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)下列有关说法不正确的是( )

A. 该电池的放电的反应式为Li1-xMnO2+LixC6=LiMnO2+C6
B. K与M相接时,A是阳极,发生氧化反应
C. K与N相接时,Li+由A极区迁移到B极区
D. 在整个充、放电过程中至少存在3种形式的能量转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化的说法正确的是

A. 如图所示的化学反应中,反应物的键能之和大于生成物的键能之和
B. 相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C. 金刚石在一定条件下转化成石墨能量变化如图所示,热反应方程式可为:C(s金刚石) =C(s,石墨) H=-(E2—E3)kJ·mol—1
D. 同温同压下,H2(g)+C12(g)==2HCl(g)能量变化如图所示,在光照和点燃条件下的△H相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.![]() 保持不变 D.
保持不变 D.![]()
②P1_____P2 (填“>”“=”或“不确定”,下同);反应的平衡常数:B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
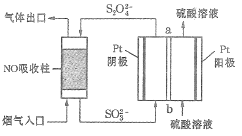
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。
已知阴极室溶液呈酸性,则阴极的电极反应式为_____________。反应过程中通过质子交换膜(ab)的![]() 为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如图:
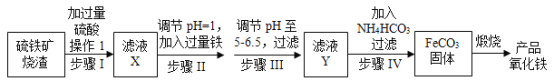
试回答下列问题:
(1)滤液X中含有的金属阳离子是___(填离子符号)。
(2)步骤Ⅱ中发生反应的离子方程式为_____。
(3)步骤Ⅲ中最好可选用___(填字母)调节溶液的pH。
A.稀硝酸 B.氨水 C.氢氧化钠溶液 D.高锰酸钾溶液
(4)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是___。
(5)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是______。
(6)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是

A.b→d反应的离子方程式为:H++OH-=H2O
B.o→a反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.c点导电能力相同,所以两溶液中含有相同量的OH–
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com