
| A. | 0.1mol/L的醋酸水溶液的pH值为3 | |
| B. | 常温下同浓度醋酸水溶液的导电性比盐酸弱 | |
| C. | 醋酸水溶液能使石蕊变红 | |
| D. | 醋酸稀溶液中同时存在CH3COOH和CH3COO- |
分析 要证明醋酸为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:A、0.1mol/L的醋酸水溶液的pH值为3,说明醋酸存在电离平衡,为弱电解质,故A不选;
B、盐酸是强电解质,相同浓度的醋酸水溶液的导电性比盐酸弱,说明醋酸存在电离平衡,为弱电解质,故B不选;
C、醋酸水溶液能使石蕊变红,只能说明醋酸的水溶液显酸性,不能证明其为弱电解质,故C选;
D、醋酸稀溶液中同时存在CH3COOH和CH3COO-,说明醋酸存在电离平衡,为弱电解质,故D不选;
故选C.
点评 本题考查了弱电解质的判断,题目难度不大,电解质强弱是根据其电离程度划分的,不能根据溶液导电性强弱划分,为易错点.


科目:高中化学 来源: 题型:选择题
 →Al(OH)3
→Al(OH)3| A. | 乙消耗原料少 | B. | 三者消耗原料相同 | ||
| C. | 丙消耗原料最少 | D. | 甲、乙消耗原料相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,ZO3-的空间构型是平面三角形;
,ZO3-的空间构型是平面三角形;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )| A. | ①②③ | B. | ②①③ | C. | ③②① | D. | ①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液产生白色沉淀 | B. | 加入碘水不变蓝 | ||
| C. | 加入BaCl2溶液没有白色沉淀产生 | D. | 加入碘水变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 加入少量0.1mol/L的盐酸,电离平衡向左移动,c(H+)减小 | |
| C. | 加入少量NaOH固体,电离平衡向右移动,溶液导电性增强 | |
| D. | 加入少量CH3COONa固体,电离平衡不移动,溶液导电性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4变成CuSO4•5H2O是物理变化 | |
| B. | 一定条件下,新制的Cu(OH)2浊液能与乙醛反应但不能与乙酸反应 | |
| C. | CuO是黑色固体,与水反应可生成Cu(OH)2 | |
| D. | Cu2O遇硝酸可能会被氧化成Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
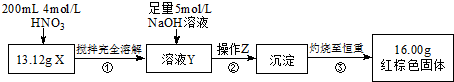
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com