
【题目】绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂。工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为_______(填>、<、=)40%。
(2)将111.2g绿矾(FeSO47H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为_______g;SO2为_______mol。实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
(3)将4.88g铁屑(含Fe2O3)与25mL 3mol/L H2SO4充分反应后,得到FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。铁屑中Fe2O3的质量分数是________(保留两位小数)。
(4)向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。t℃时,计算(NH4)2SO4·FeSO4·6H2O的溶解度。_______(保留两位小数)。
【答案】7.14 mol/L > 32 0.2 0.66(或66%) 22.35g
【解析】
(1)根据c=![]() 计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;假设密度相同,混合后质量分数为40%,由于硫酸的质量分数越大,溶液中含有的硫酸的质量越大,所以混合后硫酸的质量分数大于40%;
计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;假设密度相同,混合后质量分数为40%,由于硫酸的质量分数越大,溶液中含有的硫酸的质量越大,所以混合后硫酸的质量分数大于40%;
(2)发生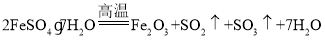 ,结合n=
,结合n=![]() 及反应计算;
及反应计算;
(3)先根据溶液的pH计算剩余硫酸的物质的量,再根据方程式计算氧化铁的质量,根据质量分数公式计算氧化铁的质量分数;
(4)根据原子守恒计算生成硫酸亚铁的物质的量及莫尔盐的物质的量,根据析出的晶体计算溶液中莫尔盐的质量,再根据![]() ,计算其溶解度。
,计算其溶解度。
(1)密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度为c=![]() mol/L≈7.14mol/L;假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%;
mol/L≈7.14mol/L;假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%;
(2)n(FeSO47H2O)=![]() =0.4mol,由
=0.4mol,由 可知,生成Fe2O3的质量为0.4mol×
可知,生成Fe2O3的质量为0.4mol×![]() ×160g/mol=32g,SO2为0.4mol×
×160g/mol=32g,SO2为0.4mol×![]() =0.2mol;
=0.2mol;
(3)根据题意知,稀释溶液至100mL,测得其pH=1,溶液中还有酸剩余,剩余的n(H2SO4)=0.1mol/L×![]() ×0.1L=0.005mol,则参加反应的n(H2SO4)=0.025L×3mol/L-0.005mol=0.07mol。设铁的物质的量是m,氧化铁的质量是n,发生反应的方程式Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,Fe+H2SO4=FeSO4+H2↑,则根据固体的质量和硫酸的物质的量可知,56m+160n=4.88,mn+3n=0.07,解得n=0.02mol,m=0.03mol,所以铁屑中Fe2O3的质量分数是
×0.1L=0.005mol,则参加反应的n(H2SO4)=0.025L×3mol/L-0.005mol=0.07mol。设铁的物质的量是m,氧化铁的质量是n,发生反应的方程式Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,Fe+H2SO4=FeSO4+H2↑,则根据固体的质量和硫酸的物质的量可知,56m+160n=4.88,mn+3n=0.07,解得n=0.02mol,m=0.03mol,所以铁屑中Fe2O3的质量分数是![]() ×100%=0.66(或66%);
×100%=0.66(或66%);
(4)根据以上结合原子守恒知,n(FeSO4)=n(Fe)+2n(Fe2O3)=(0.03+0.04)mol=0.07mol,根据莫尔盐的化学式知,n[(NH4)2SO4·FeSO4·6H2O]= n(FeSO4)=0.07mol,溶液中莫尔盐的质量为0.07mol×392g/mol-12.360g=15.08g,设莫尔盐的溶解度为x,则![]() =
=![]() ,解得x=22.35g。
,解得x=22.35g。


科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
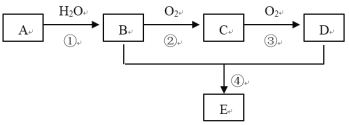
请回答下列问题:
(1)写出A的电子式 ___________。
(2)B、D分子中官能团的名称是 ___________。
(3)写出下列反应的化学方程式:
①________________;
②_________________;
④___________________,反应类型:_______。
(4)物质B可以被直接氧化为D,需要加入的试剂是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种高分子化合物,常用作有机合成的中间体,并可用作乳胶漆等。可以通过以下途径合成:

已知有机物A中含有C、H、O、Cl四种元素且同一个碳原子上不直接连接两个官能团。
(1)A的结构简式为___________或___________;反应③的反应类型_____________________。
(2) 写出反应⑤和反应⑥的化学方程式:反应⑤___________;反应⑥(在一定条件下)___________。
(3)写出1种E的同系物的名称_____________________。写出1种与F含有相同官能团的F的同分异构体的结构简式_______________。
(4)试设计一条以![]() 为原料合成
为原料合成![]() 的合成路线__________________。(合成路线常用的表示方式为:甲
的合成路线__________________。(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、A 、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37。下列说法不正确的是
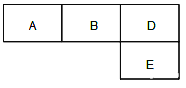
A. 沸点:M2D > BM3 > AM4 B. 原子半径:rE>rA>rB >rD
C. 化合物AnM2n分子中既含有极性鍵又含有非极性鍵 D. B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置模拟铁的电化学保护。下列说法正确的是
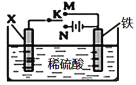
A.若X为锌棒,开关K置于M处,为外加电流阴极保护法
B.若X为碳棒,开关K置于N处,为牺牲阳极阴极保护法
C.若X为锌棒,开关K置于M处,Zn极发生:Zn-2e→Zn2+
D.若X为碳棒,开关K置于N处,X极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业合成氨可以实现大规模固氮,氨可用于生产氯化铵、硫酸铵等化学肥料。
(1)等物质的量浓度的两溶液,pH大小为:氯化铵___________硫酸铵(选填>、=或<,下同);铵根离子浓度相同的两溶液,两者的浓度大小关系为:氯化铵___________硫酸铵;
(2)检验铵态氮肥中铵根离子的实验方案是______________________________________;
(3) 长期施用硫酸铵,土壤会酸化板结的原因是__________________________________。
II.最新“人工固氮”的研究报道:常温常压、催化剂条件下,N2与水发生反应:2N2 (g)+6H2O(l)![]() 4NH3 (g)+3O2 (g) Q,(Q﹥0)。
4NH3 (g)+3O2 (g) Q,(Q﹥0)。
(4)如果反应的平衡常数K值变小,该反应正反应速率__________(选填增大、减小或不变,下同),逆反应速率__________。
(5)请用上述反应中的有关物理量来说明该反应已达到平衡状态______________________。
(6)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了0.18 g/L,在这段时间内O2的平均反应速率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
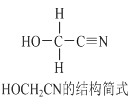
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
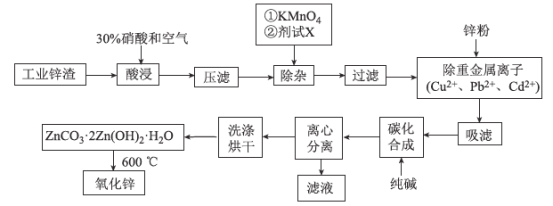
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
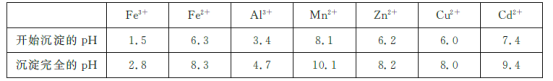
已知:相关金属离子[c(Mn+)=0.1 mol/L]生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5 mol/L左右。写出一种加快锌渣浸出的方法:_____________________________________
(2)为调节溶液的pH,则试剂X为________(填化学式),且调节溶液pH的范围是________。
(3)除杂时加入高锰酸钾的作用是___________,发生反应的离子方程式为_______________。
(4)“过滤”所得滤渣的主要成分是___________ (填化学式)。
(5)写出“碳化合成”的化学方程式:_________________________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com